题目内容
已知:在25时H2O?H++OH-,KW=10-14;CH3COOH?H++CH3COO-,Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值
(2)醋酸钠水解的离子方程式为
(3)0.5mol?L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol?L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL.混合而得,则下列说法不正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol?L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol?L-1.向其中加入固体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol?L-1,(不考虑溶液体积变化)以上三种金属离子中
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL 0.5mol?L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值
减小
减小
(填“增大”或“减小”或“不变”)(2)醋酸钠水解的离子方程式为
CH3COO-+H2O?CH3COOH+OH-;
CH3COO-+H2O?CH3COOH+OH-;
.当升高温度时,C(OH-)将增大
增大
(填“增大”“减小”“不变”);(3)0.5mol?L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol?L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为
小于
小于
,a与b的关系为大于
大于
(填“大于”“小于”“等于”);(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
.(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)
小于
小于
c(CH3COO-)(填“大于”、“小于”或“等于”),(6)若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL.混合而得,则下列说法不正确的是
BC
BC
.A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol?L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol?L-1.向其中加入固体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol?L-1,(不考虑溶液体积变化)以上三种金属离子中
Cd2+、Zn2+
Cd2+、Zn2+
能生成沉淀,原因是[OH-]=2.2×10-5mol?L-1 、[M2+][OH-]2=5×10-12(mol?L-1)3、5×10-12小于KSP[Mg(OH)2]=1.8×10-11 ,5×10-12大于KSP[Zn(OH)2]=1.2×10-17 ,5×10-12大于KSP[Cd(OH)2]=2.5×10-14.
[OH-]=2.2×10-5mol?L-1 、[M2+][OH-]2=5×10-12(mol?L-1)3、5×10-12小于KSP[Mg(OH)2]=1.8×10-11 ,5×10-12大于KSP[Zn(OH)2]=1.2×10-17 ,5×10-12大于KSP[Cd(OH)2]=2.5×10-14.
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL 0.5mol?L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
1×10-12
1×10-12
.分析:(1)根据醋酸钠固体对平衡CH3COOH?CH3COO-+H+的影响分析;
(2)醋酸根离子结合水电离的氢离子生成醋酸,反应是可逆的;醋酸根离子的水解是吸热反应;
(3)醋酸钠溶液中物质的量浓度越大,水解程度越越小,但是溶液中氢氧根离子浓度越大,溶液的PH越大;
(4)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液呈碱性;
(5)pH<7溶液显示酸性,溶液中氢离子大于氢氧根离子浓度,醋酸根离子浓度大于钠离子浓度;
(6)pH=3的HA溶液中氢离子浓度和pH=11的NaOH溶液中的氢氧根离子相等,醋酸是弱电解质,氢氧化钠是强电解质,根据这些对选项进行判断;
(7)根据离子的浓度和氢氧根离子浓度,计算出各种离子的离子积,然后根据KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14进行判断是否生成沉淀;
(8)根据10mL 0.5mol?L-1盐酸溶液,计算出氢离子的物质的量浓度,溶液稀释,氢离子物质的量不变,计算出稀释后溶液中氢离子浓度;盐酸溶液中水电离的氢离子等于溶液中氢氧根离子的浓度.
(2)醋酸根离子结合水电离的氢离子生成醋酸,反应是可逆的;醋酸根离子的水解是吸热反应;
(3)醋酸钠溶液中物质的量浓度越大,水解程度越越小,但是溶液中氢氧根离子浓度越大,溶液的PH越大;
(4)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液呈碱性;
(5)pH<7溶液显示酸性,溶液中氢离子大于氢氧根离子浓度,醋酸根离子浓度大于钠离子浓度;
(6)pH=3的HA溶液中氢离子浓度和pH=11的NaOH溶液中的氢氧根离子相等,醋酸是弱电解质,氢氧化钠是强电解质,根据这些对选项进行判断;
(7)根据离子的浓度和氢氧根离子浓度,计算出各种离子的离子积,然后根据KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14进行判断是否生成沉淀;
(8)根据10mL 0.5mol?L-1盐酸溶液,计算出氢离子的物质的量浓度,溶液稀释,氢离子物质的量不变,计算出稀释后溶液中氢离子浓度;盐酸溶液中水电离的氢离子等于溶液中氢氧根离子的浓度.
解答:解:(1)因醋酸钠固体电离产生CH3COO-,c(CH3COO-)增大,使的平衡CH3COOH?CH3COO-+H+逆向移动,C(H+)减小,C(CH3COOH)增大,所以C(H+)与C(CH3COOH)的比值减小,故答案为:减小;
(2)醋酸钠水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,该反应是吸热反应,温度升高,溶液中氢氧根离子浓度增大,
故答案为:CH3COO-+H2O?CH3COOH+OH-;增大;
(3)由于醋酸钠溶液中,醋酸钠的浓度越大,水解程度越小,但是溶液中的氢氧根离子的物质的量浓度反而越大,溶液的PH越大,所以m小于n,a大于b,
故答案为:小于;大于;
(4)醋酸为弱电解质,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液呈碱性,c(OH-)>c(H+),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)>c(CH3COO-),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)由于溶液的PH小于7,溶液中氢离子物质的量浓度大于氢氧根离子的浓度,氢离子主要是醋酸电离的,所以醋酸根离子浓度大于钠离子浓度,
故答案为:小于;
(6)A、若反应后溶液呈中性,溶液中氢离子浓度=氢氧根离子浓度=1×10-7mol?L-1c(H+)+c(OH-)=2×10-7mol?L-1,故A说法正确;
B、醋酸是弱电解质部分电离,醋酸的浓度大于氢氧化钠的浓度,若V1=V2,反应后溶液pH一定小于7,故B说法错误;
C、若反应后溶液呈酸性,由于醋酸浓度大于氢氧化钠浓度,则V1≤V2,故C说法错误;
D、若反应后溶液呈碱性,由于V1=V2溶液显示酸性,所以V1一定小于V2,故D说法正确;
故选:BC;
(7)溶液中氢氧根离子浓度是:[OH-]=2.2×10-5mol?L-1,根据[M2+][OH-]2=5×10-12(mol?L-1)3,
由于5×10-12小于KSP[Mg(OH)2]=1.8×10-11,没有氢氧化镁沉淀生成,
由于5×10-12大于KSP[Zn(OH)2]=1.2×10-17,有氢氧化锌沉淀生成,
由于5×10-12大于KSP[Cd(OH)2]=2.5×10-14,有Cd(OH)2沉淀生成,
故答案为:Cd2+、Zn2+;
(8)稀释后溶液中的氢离子浓度是:c(H+)=
=0.01mol/L,由于盐酸溶液中,水电离的氢离子浓度等于溶液中的氢氧根离子的浓度,该溶液中由水电离出的c(H+)=1×10-12,
故答案为:1×10-12.
(2)醋酸钠水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,该反应是吸热反应,温度升高,溶液中氢氧根离子浓度增大,
故答案为:CH3COO-+H2O?CH3COOH+OH-;增大;
(3)由于醋酸钠溶液中,醋酸钠的浓度越大,水解程度越小,但是溶液中的氢氧根离子的物质的量浓度反而越大,溶液的PH越大,所以m小于n,a大于b,
故答案为:小于;大于;
(4)醋酸为弱电解质,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液呈碱性,c(OH-)>c(H+),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)>c(CH3COO-),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)由于溶液的PH小于7,溶液中氢离子物质的量浓度大于氢氧根离子的浓度,氢离子主要是醋酸电离的,所以醋酸根离子浓度大于钠离子浓度,
故答案为:小于;
(6)A、若反应后溶液呈中性,溶液中氢离子浓度=氢氧根离子浓度=1×10-7mol?L-1c(H+)+c(OH-)=2×10-7mol?L-1,故A说法正确;
B、醋酸是弱电解质部分电离,醋酸的浓度大于氢氧化钠的浓度,若V1=V2,反应后溶液pH一定小于7,故B说法错误;
C、若反应后溶液呈酸性,由于醋酸浓度大于氢氧化钠浓度,则V1≤V2,故C说法错误;
D、若反应后溶液呈碱性,由于V1=V2溶液显示酸性,所以V1一定小于V2,故D说法正确;
故选:BC;
(7)溶液中氢氧根离子浓度是:[OH-]=2.2×10-5mol?L-1,根据[M2+][OH-]2=5×10-12(mol?L-1)3,
由于5×10-12小于KSP[Mg(OH)2]=1.8×10-11,没有氢氧化镁沉淀生成,
由于5×10-12大于KSP[Zn(OH)2]=1.2×10-17,有氢氧化锌沉淀生成,
由于5×10-12大于KSP[Cd(OH)2]=2.5×10-14,有Cd(OH)2沉淀生成,
故答案为:Cd2+、Zn2+;
(8)稀释后溶液中的氢离子浓度是:c(H+)=
| 0.5mol?L-1×0.01L |
| 0.5L |
故答案为:1×10-12.
点评:本题考查弱电解质的电离平衡、盐类水解、离子浓度比较、溶液PH值的判断等,涉及的题目容量较大,本题难度中等.

练习册系列答案
相关题目
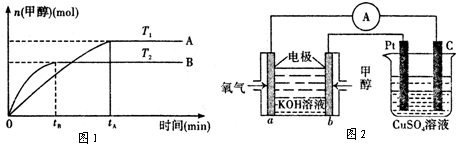
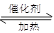 CH3OH(g)+H2O (g ).在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
CH3OH(g)+H2O (g ).在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)