网址:http://m.1010jiajiao.com/timu3_id_351120[举报]
新华社2009年10月15日报道:全国农村应当在“绿色生态—美丽多彩—低碳节能—循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s)+![]()

则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H= 。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K的值 (填“增大”、“减小”或“不变”)
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,则在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
①从反应开始到平衡,氢气的平均反应速率v(H2)= ;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入H2
C.再充入CO2 D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看习题详情和答案>>在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
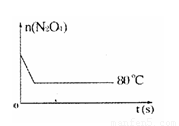
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
查看习题详情和答案>>
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
查看习题详情和答案>>
Ⅰ、北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l) ;ΔH=–571.6kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;ΔH=–890.3kJ·mol-1
C(S)+O2(g)=CO2(g) ;ΔH=–393.5kJ·mol-1
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是 。
⑵根据以上反应,则C(S)+2H2(g)=CH4(g)的焓变ΔH= 。
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:
。
Ⅱ、据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是 。
⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
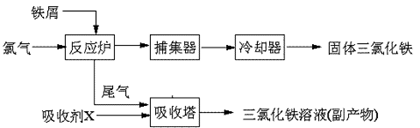
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为: ▲ 。
(2)已知六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3?6H2O的方法是: ▲ 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ▲ mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)吸收剂X是: ▲ ;吸收塔中吸收剂X的作用是: ▲ 。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32—=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: ▲ 。
(6)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+ – 2e- = 2Fe3+
阴极反应为: ▲ k* s* 5* u
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):
▲