摘要:题型四:已知一个可逆反应.一种起始状态 [例4]把6 mol A气体和5 mol B气体混合放入4 L密闭容器中.在一定条件下发生反应:3A 2C经5min达到平衡.此时生成C为2mol.测定D的平均反应速率为0.1mol/.下列说法中错误的是 A.A的平均反应速率为0.15mol/ B.恒温达到平衡时容器内压强为开始时的85% C.B的转化率为20% D.平衡时A的浓度为0.8mol/L [方法点拨]有关化学平衡的计算可按“起始.转化.平衡 列出各自的量.若碰到未知量则设出.再从题目中寻找已知关系列出等式求解. [例5]某温度下.在一容积可变的容器中.反应2A 2C(g) 达到平衡时.A.B和C的物质的量分别为4 mol.2 mol和4 mol.保持温度和压强不变.对平衡混合物中三者的物质的量做如下调整.可使平衡右移的是(C ) A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol [方法点拨]涉及化学平衡移动的问题可按下图去思考: 反应特征 影响因素 速率变化 移动方向 题型五:已知一个可逆反应.两种起始状态 [例6]可逆反应A2C(g)在固定容积的容器中进行.如果向容器中充入1mol A和1mol B.在某温度下达到平衡时.C的体积分数为m%,若向容器中充入1mol C.在同样的温度下达到平衡时.C的体积分数为n%.则m和n的关系正确的是 A.m>n B.m<n C.m=n D.无法比较 [例7]在一密闭的容器中充入2mol A和1mol B发生反应:2AxC(g).达到平衡后.C的体积分数为w%,若维持容器的容积和温度不变.按起始物质的量A:0.6mol.B:0.3mol.C:1.4mol充入容器.达到平衡后.C的体积分数仍为w%.则x的值为 A.只能为2 B.只能为3 C.可能为2.也可能为3 D.无法确定 [例8]在一个盛有催化剂容积可变的密闭容器中.保持一定温度和压强.进行以下反应:N2+3H22NH3.已知加入1mol N2和4mol H2时.达到平衡后生成a mol NH3.在相同温度.压强下.保持平衡时各组分的体积分数不变.对下列编号①-③的状态.填写表中空白. 已知 编号 起始状态物质的量 n/mol 平衡时NH3的物质的量 n/mol N2 H2 NH3 1 4 0 a ① 1.5 6 0 ② 1 0.5a ③ m g(g≥4m) [方法点拨]已知一个可逆反应.两种起始状态可从以下角度考虑: 两边系数相等:若对应物质成比例则从等效平衡,若对应物质相等则从等同平衡角度考虑 恒温恒容 两边系数不等:从等同平衡角度考虑 恒温恒压:若对应物质成比例则从等效平衡角度考虑,若对应物质相等则从等同平衡角度考虑, 题型六:通过建立等效平衡的中间状态.比较反应物 转化率的大小以及平衡时某物质体积分数.浓度的大小 [例9]体积相同的甲.乙两个容器中.分别充有等物质的量的SO2和O2.在相同温度下发生反应:2SO2+O22SO3并达到平衡.在这过程中.甲容器保持体积不变.乙容器保持压强不变.若甲容器中SO2的转化率为p%.则乙容器中SO2的转化率为 A.等于p% B.大于p% C.小于p% D.无法判断 [例10]在相同温度下.有相同体积的甲.乙两容器.甲容器中充入1g N2和1g H2.乙容器中充入2g N2和2g H2.下列叙述中.错误的是 A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲 C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲 题型七:已知两个可逆反应 [例11]在一个容器固定的反应器中.有一可左右滑动的密闭隔板.两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A.B和C均为4.0mol.D为6.5mol.F为2.0mol.设E为xmol.当x在一定范围内变化时.均可以通过调节反应器的温度.使两侧反应都达到平衡.并且隔板恰好处于反应器正中位置.请填写以下空白: ⑴若x=4.5.则右侧反应在起始时向 正反应 (填“正反应“或 逆反应“)方向进行.欲使起始反应维持向该方向进行.则x的最大取值应小于 7 . ⑵若x分别为4.5和5.0.则在这两种情况下.当反应达平衡时.A的物质的量是否相等?(填“相等 .“不相等 或“不能确定 ).其理由是: 不相等 . [方法点拨]当已知两个可逆反应时.应着力去找两平衡间的关系.然后再去计算. [巩固练习]1.反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在5L的密闭容器中进行.半分钟后NO的物质的量增加了0.3mol.则此反应的平均速率为 A. B. C. D.
网址:http://m.1010jiajiao.com/timu3_id_351075[举报]
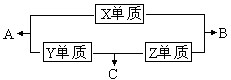 X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而W的单质在常温常压下为固体,并且W元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置
第2周期第ⅥA族
第2周期第ⅥA族
,Y单质的电子式

(2)化合物C在一定条件下生成化合物A的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,恰好完全反应时溶液呈
酸
酸
性(填“酸”、“碱”、“中”);此时溶液中离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.(4)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为
NH4++HCO3-+2OH-
NH3↑+2H2O+CO32-
| ||
NH4++HCO3-+2OH-
NH3↑+2H2O+CO32-
.
| ||
(5)由X、Z、W三种元素可以形成化合物W2Z6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则该反应的化学方程式为
CH3CH2OH+CuO
CH2CHO+Cu+H2O
| △ |
CH3CH2OH+CuO
CH2CHO+Cu+H2O
.| △ |
A、B、C、D、E、F、G七种短周期元素的原子序数依次增大.A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y );D形成的分子为单原子分子.回答问题:
(1)D元素的名称为
 .
.
(2)写出液态化合物Y的一种用途
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式:
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8kJ热量.查资料可知:
2Y(1)=2X(1)+C2(g)△H=-196.4kJ?mol-1写出液态W与气态C2反应生成液态X和气态B2的热化学方程式为
(6)G为氯,以K2CrO4为指示剂,用标准硝酸银溶液可以测定溶液中Cl-的浓度,已知Ksp(AgCl)=1.56ⅹ10-10,Ksp(Ag2CrO4)=1.10ⅹ10-12,Ag2CrO4为砖红色,则滴定终点的现象是
查看习题详情和答案>>
(1)D元素的名称为
氖
氖
,F形成的离子的结构示意图为

(2)写出液态化合物Y的一种用途
一定浓度的H2O2溶液作消毒剂
一定浓度的H2O2溶液作消毒剂
.(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
,使用这种气球存在的隐患是易燃、易爆
易燃、易爆
.(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式:
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8kJ热量.查资料可知:
2Y(1)=2X(1)+C2(g)△H=-196.4kJ?mol-1写出液态W与气态C2反应生成液态X和气态B2的热化学方程式为
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.2kJ?mol-1
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.2kJ?mol-1
.该反应还可设计为原电池(以KOH溶液为电解质溶液),请写出该电池的负极反应式:N2H4-4e-+4OH-=N2+4H2O
N2H4-4e-+4OH-=N2+4H2O
.(6)G为氯,以K2CrO4为指示剂,用标准硝酸银溶液可以测定溶液中Cl-的浓度,已知Ksp(AgCl)=1.56ⅹ10-10,Ksp(Ag2CrO4)=1.10ⅹ10-12,Ag2CrO4为砖红色,则滴定终点的现象是
滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉,振荡后砖红色沉淀不溶解
滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉,振荡后砖红色沉淀不溶解
.
有A、B、C、D四种短周期元素。已知一个B原子核的原子受到α粒子的轰击得到一个A原子的原子核和一个C原子的原子核,又知C、D元素同主族,且能发生下面两个反应,如下图。
A、B的化合物+B、C的化合物![]() B单质+A、C的化合物
B单质+A、C的化合物
A、D的化合物+D、C的化合物![]() D单质+A、C的化合物
D单质+A、C的化合物
请完成下列问题:
(1)比较B、C原子半径大小;画出D离子的结构示意图。
(2)分别写出上述两个反应方程式。
查看习题详情和答案>>