题目内容
有下列二个反应:①Fe(s)+CO2(g)═FeO(s)+CO(g),平衡常数为K1;②Fe(s)+H2O(g)═FeO(s)+H2(g),平衡常数为K2.测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
(2)在一个体积为10L的密闭容器中,加入足量的Fe、FeO粉末,然后:
①再充入CO2和H2O(g)各1mol,控制一定的温度,以上二个反应同时达到平衡.在 ℃
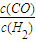 的值最大.
的值最大.②再充入CO22mol和H2 4mol,控制在900℃,以上二个反应达到平衡后,计算平衡时氢气的体积分数 .
【答案】分析:(1)令CO2的浓度变化量为cmol/L,由方程式可知CO的浓度为cmo/L,根据平衡常数列方程计算c,再根据二氧化碳转化率= ×100%计算;
×100%计算;
(2)①、使 的值最大,应使反应①的进行程度最大,反应②的进行程度最小,结合表中数据判断;
的值最大,应使反应①的进行程度最大,反应②的进行程度最小,结合表中数据判断;
②、反应前后气体的总体积不变,故平衡后混合气体总的物质的量为6mol,令参加反应的氢气的物质的量为xmol,利用三段式用x表示反应②平衡时各组分的物质的量,代入平衡常数表达式列方程计算,据此解答.
解答:解:(1)令CO2的浓度变化量为cmol/L,由方程式可知CO的浓度为cmo/L,则: =1,解得c=1,故二氧化碳的转化率=
=1,解得c=1,故二氧化碳的转化率= ×100%=50%,
×100%=50%,
故答案为:50%;
(2)①、由表中数据可知,900℃时反应①的平衡常数最大、反应②的平衡常数最小,故900℃时反应①的进行程度最大,反应②的进行程度最小,即900℃时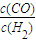 的值最大,
的值最大,
故答案为:900;
②、反应前后气体的总体积不变,故平衡后混合气体总的物质的量为6mol,令参加反应的氢气的物质的量为xmol,则:
Fe(s)+H2O(g)═FeO(s)+H2(g),
开始(mol):0 4
变化(mol):x x
平衡(mol):x 4-x
反应前后气体体积不变,则 =1.5,解得x=1.6,
=1.5,解得x=1.6,
故平衡后氢气的体积分数=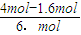 ×100%=40%,
×100%=40%,
故答案为:40%.
点评:本题考查根据化学平衡常数进行的有关计算,难度不大,注意化学平衡常数意义与用途.
 ×100%计算;
×100%计算;(2)①、使
 的值最大,应使反应①的进行程度最大,反应②的进行程度最小,结合表中数据判断;
的值最大,应使反应①的进行程度最大,反应②的进行程度最小,结合表中数据判断;②、反应前后气体的总体积不变,故平衡后混合气体总的物质的量为6mol,令参加反应的氢气的物质的量为xmol,利用三段式用x表示反应②平衡时各组分的物质的量,代入平衡常数表达式列方程计算,据此解答.
解答:解:(1)令CO2的浓度变化量为cmol/L,由方程式可知CO的浓度为cmo/L,则:
 =1,解得c=1,故二氧化碳的转化率=
=1,解得c=1,故二氧化碳的转化率= ×100%=50%,
×100%=50%,故答案为:50%;
(2)①、由表中数据可知,900℃时反应①的平衡常数最大、反应②的平衡常数最小,故900℃时反应①的进行程度最大,反应②的进行程度最小,即900℃时
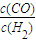 的值最大,
的值最大,故答案为:900;
②、反应前后气体的总体积不变,故平衡后混合气体总的物质的量为6mol,令参加反应的氢气的物质的量为xmol,则:
Fe(s)+H2O(g)═FeO(s)+H2(g),
开始(mol):0 4
变化(mol):x x
平衡(mol):x 4-x
反应前后气体体积不变,则
 =1.5,解得x=1.6,
=1.5,解得x=1.6,故平衡后氢气的体积分数=
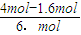 ×100%=40%,
×100%=40%,故答案为:40%.
点评:本题考查根据化学平衡常数进行的有关计算,难度不大,注意化学平衡常数意义与用途.

练习册系列答案
相关题目
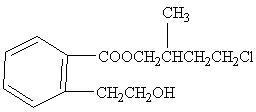
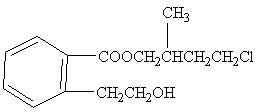
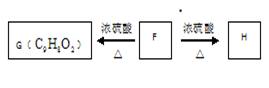
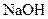 水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是 。
水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式是 。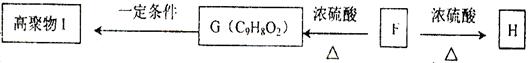
 溶液发生显色反应
溶液发生显色反应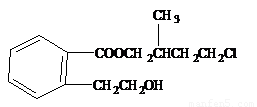
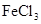 溶液发生显色反应
溶液发生显色反应