摘要:36.将0.1mol铁粉和0.05mol硫粉均匀混合后.铺在石棉网上加热引燃.完全反应后.将残渣全部放入过量的稀H2SO4中充分反应.结果所产生的气体的体积在标准状况下明显少于2.24L.其主要原因是 .
网址:http://m.1010jiajiao.com/timu3_id_350889[举报]
下列说法正确的是( )
A.把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol?L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B.将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C.现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D. 某溶液中可能含有H+、Na+、
某溶液中可能含有H+、Na+、 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、 、Mg2+、Al3+
、Mg2+、Al3+
查看习题详情和答案>>
A.把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol?L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B.将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C.现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D.
 某溶液中可能含有H+、Na+、
某溶液中可能含有H+、Na+、 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、 、Mg2+、Al3+
、Mg2+、Al3+查看习题详情和答案>>
下列说法正确的是
- A.把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol?L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
- B.将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
- C.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
- D.
 某溶液中可能含有H+、Na+、
某溶液中可能含有H+、Na+、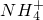 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、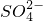 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、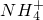 、Mg2+、Al3+
、Mg2+、Al3+
下列说法正确的是
[ ]
A. 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol·L-1。该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B. 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况)。反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C. 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
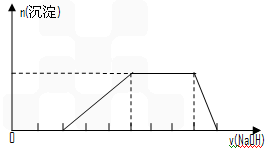
D. 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+ 、Al3+ 、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如上图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+ 、Al3+
查看习题详情和答案>>
B. 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况)。反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C. 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D. 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+ 、Al3+ 、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如上图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+ 、Al3+
 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.(1)氨和铵盐在粮食的增产中发挥着极其重要的作用,同时又是重要的工业原料.
①写出实验室制取氨气的化学方程式:
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O
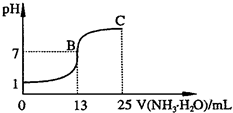
;②常温下,向25mL 0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1NH3?H2O溶液,曲线如图所示(体积变化忽略不计).由图确定HA是
强
强
(填“强”或“弱”)酸,HA与NH3?H2O恰好完全反应时,混合溶液中由水电离出的c(H+)>
>
(填“>”、“>”或“=”)0.1mol?L-1HA溶液中由水电离出的c(H+);写出C点时混合溶液中各离子浓度由大到小的顺序为c(NH4+)>c(A-)>c(OH-)>c(H+)
c(NH4+)>c(A-)>c(OH-)>c(H+)
;(2)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机.这类材料中研究得较多的是氮化物A.粉末状A能够与水反应,所得产物中有一种酸性氧化物,它是工业上生产玻璃的主要原料,另一种产物是氨气.请写出A与水反应的化学方程式
Si3N4+6H2O=3SiO2+4NH3↑
Si3N4+6H2O=3SiO2+4NH3↑
;(3)硝酸是医药、军事、化工等领域的重要原料.在实验室中,将适量铁铜混合粉末与稀硝酸充分反应后得到溶液X.若有固体剩余,实验测得溶液X中大量存在的阳离子只有两种,则阳离子为
Fe2+、Cu2+
Fe2+、Cu2+
(写离子符号);若反应后无固体剩余,某同学认为X中除Fe3+、Cu2+外还可能含有Fe2+,若要确认其中的Fe2+,应选用c
c
(选填序号).a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KmnO4溶液 d.浓氨水.