网址:http://m.1010jiajiao.com/timu3_id_350406[举报]
(本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
| t c | 初始 | 2min | 4min | 6min | 8min |
| c(A)( mol·L -1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
| c(B)( mol·L -1) | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
| c(C)( mol·L -1) | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
(1)前2mim内,v(B)= 。
(2) 到2mim末A 的转化率为 。
(3)该反应的化学方程式为 。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为 (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为 mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则 是原来的2倍。
a. A的转化率 b. B的平衡浓度 表 c.达到平衡的时间 d.平衡时气体的密度 查看习题详情和答案>>
(本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
|
t c |
初始 |
2min |
4min |
6min |
8min |
|
c(A)( mol·L -1) |
2.50 |
2.20 |
2.00 |
2.00 |
2.20 |
|
c(B)( mol·L -1) |
1.56 |
2.16 |
2.56 |
2.56 |
2.16 |
|
c(C)( mol·L -1) |
0.39 |
0.54 |
0.64 |
0.64 |
1.54 |
请填空:
(1)前2mim内,v(B)= 。
(2) 到2mim末A 的转化率为 。
(3)该反应的化学方程式为 。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为 (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为 mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则 是原来的2倍。
a. A的转化率 b. B的平衡浓度 表 c.达到平衡的时间 d.平衡时气体的密度
查看习题详情和答案>>
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.
(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g)2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A.+
=1 B.2
=
C.a+b=14.9 D.c1=c2=c3
查看习题详情和答案>>
(12分,本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分)
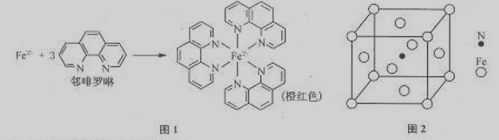
(1)Fe2+在基态时,核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子有 ,羟胺熔沸点较高,是因为分子间存在较强的 。
(3)Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为 。
(4)根据价层互诉理论,C1O4—空间构形为 。
(5)铁能与氮形成一种磁性材料,其晶胞结构如图2,则该磁性材料的化学式为 。
B.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
①将三口烧瓶和锥形瓶做干燥处理,先向三口烧瓶中加入20g菜籽油,再称取40g正已烷(约61mL)。
②称取甲醇4.6g(约5.8mL)放到锥形瓶中,然后称取0.2g氢氧化钠固体并使之溶解,然后加到三口烧瓶中。
③如下图所示安装三口烧瓶。
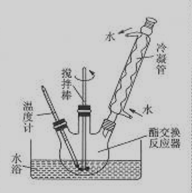
④恒温水浴加热,使温度保持在60—65℃左右,搅拌1.5—2h。
⑤停止加热后,冷却,取出三口烧瓶,静置、分液,上层
为生物紫油,正已烷和甲醇,下层主要为甘油。
⑥用温水洗涤制得的生物柴油3—4次。
⑦将水洗后的溶液倒入圆底烧瓶中,蒸馏,温度保持在
120℃左右,直至无液体蒸出后,烧瓶中剩余的液体主要即为
生物柴油。
(1)氢氧化钠的作用是 。
(2)正已烷的作用是 。
(3)图中冷凝管的作用是 。
(4)步骤⑤分液,用到的主要的一种玻璃仪器是 (写名称)
(5)确定步骤⑥已洗涤干净的方法是 。
(6)酸价(1g油酯的游离脂肪酸所需氢氧化钾的毫克数)的测定
a. 称取均匀试样Wg注入锥形瓶中,加入石油醚—乙醇混合液25mL,摇动锥形瓶使试样溶解。
b.滴入3滴酚酞,用0.100 mol/L KOH溶液滴定至出现微红色且保持30s不消失,消耗KOH溶液VmL。
则该生物柴油的酸价为 (用含W、V的代数式表示)
查看习题详情和答案>>
(12分)随着氮氧化物污染的日趋严重,我国将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法:
(1)用活性炭还原法处理氮氧化物。有关反应为:C(g)+2NO(g) N2(g)+CO2(g) △H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
N2(g)+CO2(g) △H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,经过一段时间后反应重新达到平衡,则改变的条件可能是
③若30min后升高温度至T2℃,达到平衡时,容器中的NO、N2、CO2的浓度之比为5:3:3,则该反应的△H (填“>”、“<”或“=”)0
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H20(g) △H=-574kJ.mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ.mol-1
③H2O(g)=H2O(l) △H=-44.0kJ.mol-1
写出CH4和NO2反应生成N2(g) 、CO2(g)和 H2O(l)的热化学方程式:
(3)选择性催化还原(SCR)脱硝技术是目前应用最广、最有效的烟气脱硝技术之一。该技术涉及以下反应:4NO(g)+4NH3(g)+ O2(g)=在4N2(g)+ 6H2O(g),在恒容的密闭容器中,下列有关说法中正确的是 (填字母)
A.其他条件不变,使用高效催化剂,烟气中NO的转化率增大
B.单位时间内消耗NH3和NO的物质的量之比为1:1时,反应达到平衡
C.其他条件不变时升高温度,反应的平衡常数减小
D.反应达到平衡后,再向容器中充入等量的反应物,再次达到平衡时,NO的转化率减小
(4)以NO2 、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,该电极的电极反应可表示为
 查看习题详情和答案>>
查看习题详情和答案>>