摘要:找到解题的突破口.便是解题成功的一半.可从下列途径去找突破口. (1)从物质的组成结构方面寻找 例如.具有正四面体结构的物质可能为甲烷或白磷或铵根离子,不含金属元素的离子化合物为铵盐等. (2)从实验现象寻找 例如.向一溶液中滴入碱液.先产生白色沉淀.进而变成灰绿色.最后变成红褐色沉淀.则该溶液中一定含Fe2+,遇空气迅速由无色变为红棕色的气体必为NO.等等. (3)从反应类型寻找 例如.同一元素的气态氢化物和气态氧化物反应生成该元素的单质和水.则该元素可能为S或N,能“三合一 的反应:NH3.H2O.CO2或氢氧化亚铁.水.氧气或NO2.O2.H2O,对不常见的反应.亦必须加以注意. (4)从典型性质寻找 例如.密度最小的气体为H2,地壳中含量最多的元素为O.最多的金属元素为Al,溶解SiO2的酸为HF,遇苯酚生成紫色溶液的离子为Fe3+.等等. (5)从反应条件控制 如必须控制170oC的反应比是制取乙烯的反应,必须在沸水浴中用浓盐酸作催化剂的反应必为制酚醛树脂的反应等. (6)从数据去寻找 根据计算或题给信息.可获得某些数据.这些数据也可使我们找到突破口.如物质的熔点较低.说明为分子晶体,反之.亦可能为原子晶体. 请记好下列常用的知识规律.对解推断题会有较大帮助. (1) 具有特征性质的物质归类 ① 同一元素的气态氢化物与气态氧化物反应.生成该元素的单质与水.元素可能是硫或氮. ② 同一元素的气态氢化物与与最高价氧化物对应的水化物化合生成盐的元素一定是氮. ③ 两溶液反应生成沉淀和气体.这两种溶液的溶质分别为:a.氢氧化钡与硫酸铵.b.可溶性铝盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐.C.可溶性铁盐与可溶性碳酸盐或碳酸氢盐.d.硫代硫酸盐与强酸. ④ 既能与酸反应.又能与碱反应物质可能是Al.Al2O3.Al(OH)3..氨基酸.弱酸的铵盐.弱酸的酸式盐等. ⑤ 既能与强酸反应放出气体又能与强碱反应放出气体.常见的物质有:Al.弱酸的铵盐[(NH4)2CO3.NH4HCO3.(NH4)2SO3.NH4HSO3.(NH4)2S.NH4HS等. ⑥ 在水中分解生成气体和难溶物或微溶物的物质可能是Al2S3.Mg3N2.CaC2等. ⑦ 与水接触放出气体的常见物质有:Li.Na.K.Na2O2.F2等. ⑧ A物质加到B物质中.先生成沉淀.后沉淀又溶解.A和B可能分别是CO2和Ca(OH)2.NaOH与铝盐.NH3与AgNO3溶液.HCl与NaAlO2.稀盐酸与Fe(OH)3胶体等. ⑨ 使溴水褪色的物质有:硫化氢.二氧化硫.不饱和烃类.活泼金属碱类等. (2) 特征的实验现象 ① H2在Cl2中燃烧呈苍白色火焰.在氯掘中燃烧生成魄烟雾的是磷.钠元素焰色反应为黄色.钾元素焰色反应为紫色.在空气中迅速由无色变为红棕色的气体是NO等. ② 遇酚酞变红的气体必为氨气. ③ 向一溶液中加入碱液.产生白色沉淀.进而变成灰绿色.最后变成红棕色.该溶液中必含有Fe2+.遇SCN-显红色或遇OH-生成红褐色沉淀或遇苯酚显紫色的离子是Fe3+. ④ 遇BaCl2生成生成不溶于稀硝酸的白色沉淀的溶液可能溶有SO42-或Ag+.遇HCl生成沉淀的溶液中可能含有Ag+.Si2O32-.S2O32-. ⑤ 具有臭鸡蛋气味的气体是H2S,与H2S反应生成淡黄色沉淀的气体可能是Cl2.O2.SO2.NO2等. ⑥ 电解电解质溶液时阳极气态产物一般是氯气和氧气.阴极气态产物是氢气. ⑦ 使品红褪色的气体可能是Cl2或SO2.物质可能是次氯酸钠.次氯酸钙.氯水.过氧化钠等. (3) 特殊的转化关系 ① 金属→碱性氧化物→碱→盐, 非金属→酸性氧化物→酸→盐. ② 交叉型转化关系 ③ 三角形转化关系 Fe.Fe2+.Fe3+,S.H2S.S2-,Al.Al3+.AlO2-,烯.醇.卤代烃.
网址:http://m.1010jiajiao.com/timu3_id_350275[举报]
 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)═2NO(g)△H=+180.6kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
则反应 C(s)+2NO(g)═CO2(g)+N2(g)△H=
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为
NO2+G
| 催化剂 |
下列化合物中,满足上述反应式中的G是
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
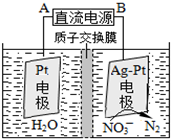
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则反应的离子方程式为:
②在酸性条件下,电化学降解NO3-的原理如图,电源正极为:
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位-“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图1:
(1)多巴胺分子式:
(2)试判断多巴胺能发生的化学反应
A.加成 B.取代 C.氧化 D.水解
(3)写出与多巴胺互为同分异构体且属于1、3、5三取代苯并且苯环上直接连有一个羟基和一个氨基且分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1的所有物质的结构简式:
 .
.
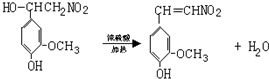
(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得.合成过程表示如图2:
 催化剂
催化剂
Ⅰ、写出下列反应类型:反应①
Ⅱ、A的结构简式: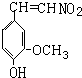
 .
.
Ⅲ、写出②、⑤两步的化学方程式:
②:

⑤:
 .
.
查看习题详情和答案>>
(1)多巴胺分子式:
C8H11NO2
C8H11NO2
.(2)试判断多巴胺能发生的化学反应
A.加成 B.取代 C.氧化 D.水解
(3)写出与多巴胺互为同分异构体且属于1、3、5三取代苯并且苯环上直接连有一个羟基和一个氨基且分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1的所有物质的结构简式:


(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得.合成过程表示如图2:
 催化剂
催化剂Ⅰ、写出下列反应类型:反应①
加成
加成
,反应②消去
消去
.Ⅱ、A的结构简式:


Ⅲ、写出②、⑤两步的化学方程式:
②:


⑤:


能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)?CH3OH(g)+Q1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应I,5分钟后测得c(CO)=0.2mol/L,计算此段时间的反应速率(用H2表达) mol/(L?min).
(2)由表中数据判断Q1 0(填“>”、“<”或“=”).
(3)若容器容积不变,下列措施可提高反应I中CO转化率的是 (选填编号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.原料气循环使用
(4)写出反应Ⅱ的平衡常数表达式:K= ;由于CO2化学惰性很大,因此找到合适的催化剂是实现该反应工业化的关键.该反应使用催化剂无法达到的效果是 (选填编号).
a.提高甲醇的单位时间产量 b.提高CO2的转化率 c.缩短达到平衡所需时间.
查看习题详情和答案>>
反应I:CO(g)+2H2(g)?CH3OH(g)+Q1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)由表中数据判断Q1
(3)若容器容积不变,下列措施可提高反应I中CO转化率的是
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.原料气循环使用
(4)写出反应Ⅱ的平衡常数表达式:K=
a.提高甲醇的单位时间产量 b.提高CO2的转化率 c.缩短达到平衡所需时间.
 快乐是什么?精神病学专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:(1)多巴胺分子式:
C8H11NO2
C8H11NO2
;(2)试判断多巴胺能发生的化学反应
ABC
ABC
;A.加成 B.取代 C.氧化 D.水解
(3)写出一种符合下列条件的与多巴胺互为同分异构体的物质的结构简式:


①属于1、3、5三取代苯并且苯环上直接连有一个羟基和一个氨基
②分别能与钠和氢氧化钠反应,且消耗钠与氢氧化钠的物质的量之比为2:1
(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得.合成过程表示如下:
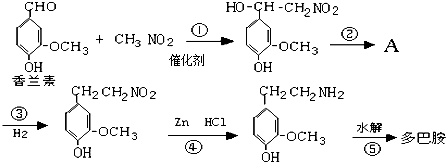
写出反应②的化学方程式: