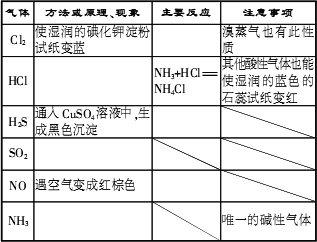
摘要:常见气体的检验: H2 O2 Cl2 HCl HBr CO SO2 NO2 H2S CO2 NO NH3
网址:http://m.1010jiajiao.com/timu3_id_350261[举报]
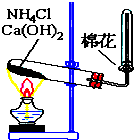 如图所示,是实验室制备某常见气体的实验装置,请填空:
如图所示,是实验室制备某常见气体的实验装置,请填空:(1)该实验装置制备的常见气体是(填写化学式):
NH3
NH3
.(2)制备该气体的化学方程式是:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(3)收集该气体的方法是:
向下排空气法
向下排空气法
.(4)检验该气体是否收集满的方法是:
用湿润的红色石蕊试纸靠近试管口,若变蓝,则说明收集满
用湿润的红色石蕊试纸靠近试管口,若变蓝,则说明收集满
.(5)将充满该气体的试管倒立于水槽中,可以看到的现象是:
试管内液面上升
试管内液面上升
.有一化合物X(不含结晶水),其水溶液为浅绿色,可发生如下的转化关系(部分反应物,生成物已略).其中B、D、E、F均为无色气体.M、L为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热.
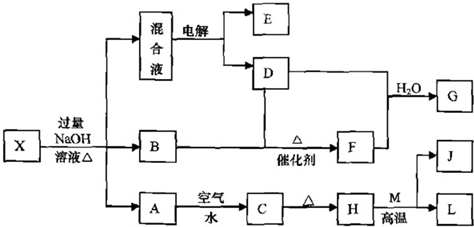
请回答下列问题:
(1)B物质的电子式为 ;B气体的检验方法为 .
(2)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应: ;
②含有L元素的置换反应: .
(3)L与过量C的稀溶液反应的离子方程式为 .
(4)物质X的化学式为 .
(5)物质X溶于水结晶析出晶体的组成可表示为X?nH2O,为测定n.称取WgX?nH2O晶体溶于水中,配制100mL溶液,再用滴定管取出10.00mL,用Cmol?L-l的酸性KMnO4溶液进行滴定,滴定所发生反应为:5L2++MnO4-+8H+=5L3++Mn2++4H2O达到滴定终点时,共用酸性KMnO4溶液VmL,则所配X溶液的溶质的物质的量浓度为 mol?L-1,由此算出X?nH2O晶体中结晶水的n值是 (以上答案用字母表示).
查看习题详情和答案>>

请回答下列问题:
(1)B物质的电子式为
(2)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应:
②含有L元素的置换反应:
(3)L与过量C的稀溶液反应的离子方程式为
(4)物质X的化学式为
(5)物质X溶于水结晶析出晶体的组成可表示为X?nH2O,为测定n.称取WgX?nH2O晶体溶于水中,配制100mL溶液,再用滴定管取出10.00mL,用Cmol?L-l的酸性KMnO4溶液进行滴定,滴定所发生反应为:5L2++MnO4-+8H+=5L3++Mn2++4H2O达到滴定终点时,共用酸性KMnO4溶液VmL,则所配X溶液的溶质的物质的量浓度为
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:

(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为
②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为
 .
.
(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法
查看习题详情和答案>>

(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为
SO32-+SO2+H2O=2HSO3-
SO32-+SO2+H2O=2HSO3-
.②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为


(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法
用蘸有浓盐酸的玻璃棒检验
用蘸有浓盐酸的玻璃棒检验
.X转化为Y的化学方程式为4NH3+5O2
4NO+6H2O
| ||
| 高温高压 |
4NH3+5O2
4NO+6H2O
.
| ||
| 高温高压 |