摘要: 一定条件下, 在容积为2L的密闭容器中, 将2molL气体和3molM气体相混合,发生如下反应: 2LQ 该反应达平衡时, 生成2.4molR, 并测得Q的浓度为0.4mol/L. 下列有关叙述正确的是 [ ] A. x值为2 B. 混合气体的密度变大 C. 平衡时M的浓度为0.6mol/L D. L的转化率为80%
网址:http://m.1010jiajiao.com/timu3_id_349672[举报]
一定条件下,在恒容密闭容器中,发生化学反应X(s)+2Y(g)?2Z(g).下列说法中:①X、Y、Z的物质的量之比1:2:2;②混合气体的密度不在改变;③容器中的压强不再发生变化;④单位时间内生成n molZ,同时生成n mol Y上述说法中一定达到化学平衡状态的是( )
查看习题详情和答案>>
 (2009?重庆)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.
(2009?重庆)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.(1)图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是
氯气
氯气
;NaOH溶液的出口为a
a
(填字母);精制饱和食盐水的进口为d
d
(填字母);干燥塔中应使用的液体是浓硫酸
浓硫酸
.(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注.
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
SiCl4+2H2+O2
SiO2+4HCl
| ||
SiCl4+2H2+O2
SiO2+4HCl
.
| ||
②SiCl4可转化为SiHCl3而循环使用.一定条件下,在20L恒容密闭容器中的反应:3SiCl4(g)+2H2(g)+Si(g)
 4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为
4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为0.351
0.351
kg.(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
134.4
134.4
M3(标准状况).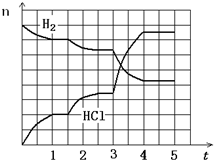 (2013?河东区一模)工业上高纯硅可以通过下列反应制取:
(2013?河东区一模)工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)
| 高温 |
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为
此空删除
此空删除
0.1mol/(L?min),3min后达到平衡,此时获得固体的质量8.4
8.4
g.(2)该反应的平衡常数表达式K=
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
升温
升温
使K增大.(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是
ac
ac
.a.2v逆(SiCl4)=v正(H2) b.断开4mol Si-Cl键的同时,生成4mol H-Cl键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如右图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是
减压
减压
,第3分钟改变的条件是升温
升温
,各平衡态中氢气转化率最小的时间段是1-1.5min
1-1.5min
. 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是( )
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是( )