摘要:24.(1)反应2S(s)+O2 (g)2SO2(g)的平衡常数表达式为 .平衡体系中.加入18O构成的氧气.当平衡发生移动后.SO2中18O的含量 .其原因是 . (2)CuCl2溶液有时呈黄色.有时呈黄绿色或蓝色.这是因为在CuCl2的水溶液中存在如下平衡[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O. 蓝色 黄色 现欲使溶液由黄色变成黄绿色或蓝色.请写出两种可采用的方法: ① , ② .
网址:http://m.1010jiajiao.com/timu3_id_348882[举报]
已知以下信息:
①1mol N2的共价键断裂吸收946kJ的能量;1mol H2的共价键断裂吸收436kJ的能量;形成1mol NH3中的化学键释放1173kJ的能量.
②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
根据以上相关数据回答问题:
(1)用H2表示该反应2s内的平均反应速率为
(2)
(3)写出该反应的化学方程式
(4)氮气和氢气生成氨气的过程
查看习题详情和答案>>
①1mol N2的共价键断裂吸收946kJ的能量;1mol H2的共价键断裂吸收436kJ的能量;形成1mol NH3中的化学键释放1173kJ的能量.
②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
| N2(mol?L-1) | H2(mol?L-1) | NH3(mol?L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
(1)用H2表示该反应2s内的平均反应速率为
0.6 mol?L-1?s-1
0.6 mol?L-1?s-1
(2)
不能
不能
(填“能”或“不能”)确认该反应2s末已达化学平衡状态.(3)写出该反应的化学方程式
N2+3H2  2NH3
2NH3
 2NH3
2NH3N2+3H2  2NH3
2NH3
 2NH3
2NH3(4)氮气和氢气生成氨气的过程
释放
释放
(填“释放”或“吸收”)能量.偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中还原剂是
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g)(Ⅱ)
当温度降低时,气体颜色变浅,则反应(Ⅱ)为
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
查看习题详情和答案>>
(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中还原剂是
(CH3)2NNH2
(CH3)2NNH2
.(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g)(Ⅱ)
当温度降低时,气体颜色变浅,则反应(Ⅱ)为
吸热
吸热
(填“吸热”或“放热”)反应.(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
ad
ad
.
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
不变
不变
(填“增大”“不变”或“减小”),反应2s后NO2的物质的量为0.8mol,则0~2s的平均反应速率v(N2O4)=0.2
0.2
mol?L-1?s-1.二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜( ),有关反应如下:
),有关反应如下:
反应①2CH3OH(l)+H2S(g)=(CH3)2S(l)+2H2O(l)△H=-akJ?mol-1
反应②(CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g)△H=-bkJ??mol-1
反应③2NO(g)+O2(g)=2NO2(g)△H=-ckJ?mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
(2)能说明反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)达平衡状态的是
A.v(CH3OH)=2v(H2S)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K=
.

(4)上图是反应③在一定条件下发生反应,反应物和生成物能量与活化能的关系.在图中曲线
(5)N2O5是一种新型绿色硝化剂,其制备方法有以下两种.
方法一:4NO2(g)+O2(g)=2N2O5(g);△H=-56.76KJ?mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:

硼氢化钠燃料电池的正极反应式
查看习题详情和答案>>
 ),有关反应如下:
),有关反应如下:反应①2CH3OH(l)+H2S(g)=(CH3)2S(l)+2H2O(l)△H=-akJ?mol-1
反应②(CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g)△H=-bkJ??mol-1
反应③2NO(g)+O2(g)=2NO2(g)△H=-ckJ?mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
2(CH3)2S(l)+O2(g)=2(CH3)2SO(l)△H=-(2b+c)kJ?mol-1
2(CH3)2S(l)+O2(g)=2(CH3)2SO(l)△H=-(2b+c)kJ?mol-1
,(2)能说明反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)达平衡状态的是
BC
BC
.A.v(CH3OH)=2v(H2S)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K=
| c2(NO2) |
| C2(NO)c(O2) |
| c2(NO2) |
| C2(NO)c(O2) |

(4)上图是反应③在一定条件下发生反应,反应物和生成物能量与活化能的关系.在图中曲线
b
b
(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理是催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
;(5)N2O5是一种新型绿色硝化剂,其制备方法有以下两种.
方法一:4NO2(g)+O2(g)=2N2O5(g);△H=-56.76KJ?mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S
>
>
0(填“>、<”或“=”)方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:

硼氢化钠燃料电池的正极反应式
H2O2+2e-=2OH-
H2O2+2e-=2OH-
. 二甲基亚砜
二甲基亚砜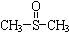 有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜(
有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜( ),有关反应如下:
),有关反应如下:反应①2CH3OH(l)+H2S(g)═(CH3)2S(l)+2H2O(l)△H=-akJ?mol-1
反应②(CH3)2S(l)+NO2(g)═(CH3)2SO(l)+NO(g)△H=-bkJ?mol-1
反应③2NO(g)+O2(g)═2NO2(g)△H=-ckJ?mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
(2)能说明反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)达平衡状态的是
A.v(CH3OH)=2v(H2S)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K=
(4)N2O5是一种新型绿色硝化剂,其制备方法有以下两种.
方法一:4NO2(g)+O2(g)=2N2O5(g);△H=-56.76KJ?mol-1常温下,该反应能逆向自发进行,则逆向反应的△S
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图,硼氢化钠燃料电池的正极反应式
(每空3分,共9分)请写出下列反应的热化学方程式:
(1)25℃时,1 g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.64kJ热量,写出该反应的热化学方程式: 。
(2)已知断裂1 mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出463kJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式: 。
(3)已知:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-a kJ·mol-1;
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-b kJ·mol-1。
则H2S与SO2两种气体转化为固体硫的热化学方程式为 。