网址:http://m.1010jiajiao.com/timu3_id_348041[举报]
A
B.溶液中含有1 mol碳酸钠?
C.这种溶液是将1 mol碳酸钠溶于
D.将
我国规定饮用水质量标准必须符合下列要求:
|
pH |
6.5~8.5 |
|
|
|
<0.0045mol/ |
|
|
细菌总数 |
<100个 |
|
以下是源水处理成自来水的工艺流程示意图:
源水![]() 曝气池
曝气池![]() 一级沉降池
一级沉降池![]() 二级沉降池
二级沉降池![]() 过滤池自来水
过滤池自来水
(1)源水中含![]() 、
、![]() 、
、![]() 、
、![]() 等,加入石灰后生成
等,加入石灰后生成![]() ,进而发生若干复分解反应,写出其中一个反应的离子方程式__________________________.
,进而发生若干复分解反应,写出其中一个反应的离子方程式__________________________.
(2)凝聚剂除去悬浮固体颗粒的过程________(填写编号).
①只是物理过程 ②只是化学过程 ③是物理和化学过程
![]() ·
·![]() 是常用的凝聚剂,它是水中最终生成________沉淀.
是常用的凝聚剂,它是水中最终生成________沉淀.
(3)通入二氧化碳的目的是________和________.
(4)气体A的作用是______________________.这种作用是基于气体A和水反应的产物具有_____________________________性.
(5)下列物质中,________可以作为气体A的代用品(填写编号).
①![]() ②
②![]() (液) ③
(液) ③![]() ④
④![]()
查看习题详情和答案>>
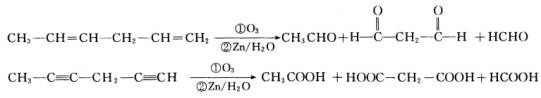
某烃分子为![]() ,在臭氧作用下发生反应:
,在臭氧作用下发生反应:
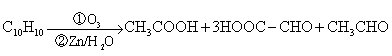
试回答:
(1)![]() 分子中含________个C=C双键,________个C≡C叁键.
分子中含________个C=C双键,________个C≡C叁键.
(2)![]() 的结构简式为________.
的结构简式为________.
查看习题详情和答案>>
已知烯烃、炔烃在臭氧作用下发生如下反应:
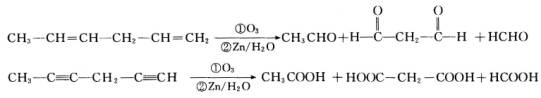
某烃分子为![]() ,在臭氧作用下发生反应:
,在臭氧作用下发生反应:
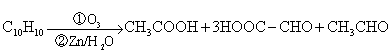
试回答:
(1)![]() 分子中含________个C=C双键,________个C≡C叁键.
分子中含________个C=C双键,________个C≡C叁键.
(2)![]() 的结构简式为________.
的结构简式为________.
查看习题详情和答案>>
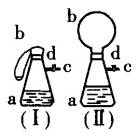
将图(Ⅰ)的装置放在托盘天平上称量,质量为![]() g.根据实验现象填写下列空白:
g.根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ).反应结束后,再次称量,质量为![]() .则
.则![]() 和
和![]() 的关系是_____________.
的关系是_____________.
(2)取25 mL6 mol/LNaOH溶液,先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气).打开d,将溶液挤入瓶中,立即夹紧d.可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失.用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失.使沉淀消失的反应的化学方程式是____________________.
(3)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解.此时瓶内温度_____________(填“不变”、“降低”或“升高”).
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状.写出这时发生的反应的化学方程式_____________.
查看习题详情和答案>>