摘要:例1如何寻找18电子的微粒? 寻找等电子微粒的技巧是结合元素周期表和等价代换思想,由此及彼,灵活迁移. P3- S2-(HS-) Cl- ↑ ↑ ↑ 18××2 SiH4 ← PH3 ← H2S ← HCl ← Ar ↓ PH4+ → K+ → Ca2+ ↓ 等价代换 CH3-CH3 ← H2N-NH2←HO-OH ←F2 [F-OH-NH2-CH3] ↓ O22- ↓ CH3-NH2 → CH3-OH → CH3-F → NH2OH → NH2F 例2 A.B分别为第三周期.第四周期同一主族的不同元素的原子.它们原子核内质子数均等于中子数.若A为ⅡA 族.其质量数为x.则B的质子数为Z.若A为ⅣA族.其质子数为y.则B的质量数为N.Z和N为下列哪一组值 ( ) A. Z:+18.N:2y+18 B: N: +18, Z:2y+18 C: Z: +8, N:2y+36 D: N: +18, Z:2y+36 解: 此题是有关元素周期表结构的考查.第三周期为短周期元素.而第四周期有过渡元素.但在ⅡA 族后才出现过渡元素.故当A为ⅡA 族.B质子数比A大8, 当A为ⅣA 族.B的质子数比A大18.根据质量数是质子数的2倍,即可得. Z: +8, N:2=2y+36 故正确答案为C. 例3.元素周期表中前7周期的元素数如下: 周期数 1 2 3 4 5 6 7 元素数 2 8 8 18 18 32 32 (1) 请分析周期数与元素数的关系.然后预言第8周期最多可能含有的元素种数为 50 (D)64 (2)推测第8周期的最终的未知稀有气体的原子序数为 170 (D)186 解析:(1)观察每一周期的元素数发现.它们都是偶数.进一步分析除以2后所得的数 周期数 1 2 3 4 5 6 7 元素数 2 8 8 18 18 32 32 2×1 2×4 2×4 2×9 2×9 2×16 2×16 2×12 2×22 2×22 2×32 2×32 2×42 2×42 从中可发现.它们遵循2×n2,除第一周期外.重复一次.故第八周期含有的元素为: 2×52,=50(种).选C (2) 推测第8周期的最终的未知稀有气体的原子序数制需要把前八周期的元素数相加可得.2 + 8 + 8+ 18+ 18+ 32+ 32 +50 = 168 选A 例4.A.B.C.D为周期表中前三周期元素.A元素原子的次外层电子数是最外层电子数的二分之一.B的阴离子核外只有一个电子层.C单质在标准状况下密度是1.43g/L.D元素的焰色反应呈黄色.将以上四种元素组成的结晶盐3.4g加热反至完全失去结晶水.其质量减少1.35g.所得无水盐中C元素的质量分数为39%.将该无水盐与适量盐酸作用得到一种弱酸.再将所得弱酸完全燃烧可得0.9g水和1.12L标准状况下的CO2.已知这种弱酸的一个分子中共有32个质子.试回答:①A.B.C.D四种元素各是什么元素?②求结晶盐化学式. 解析:A元素原子的次外层电子数是最外层电子数的二分之一.在前三周期元素中只有碳.硅符合.B的阴离子只有一个电子层.可推断B是氢.根据--所得到弱酸完全燃烧.知此弱酸为有机酸.故A为碳. C的摩尔质量=1.43g/L×22.4L/mol=32g/mol.所以C是氧. 弱酸中: n(C)==0.05mol n(H)=×2=0.1mol n(O)==0.05mol 所以弱酸的最简式为:CH2O.其中共有6+2+8=16个质子.根据一个分子中有32个质子.故弱酸化学式为:C2H4O2.即醋酸CH3COOH. 答案:①A为碳 B为氢 C为氧 D为钠 ②CH3COONa·3H2O 例5..A+.B+.C-.D.E五种微粒.每个微粒均含有10个电子 .已知: ①A++C- D+E↑ ②B++C-2D 请回答以下问题: (1)C-离子含有的化学键为 (2)具有相同空间构型的微粒是 和 ,A+中键角为 (3)分别写出A+和D反应.B+和E反应的离子方程式. A++D: B++E: 解析:有题意可推得A+ 为NH4+.B+为H3O+.C- 为OH- ,D为H2O .E为NH3NH3,H3O+,109°28 (3) NH4++H2O ≒NH3·H2O+H+. NH3+H3O+ =+H2O 巩固练习
网址:http://m.1010jiajiao.com/timu3_id_347975[举报]
 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)A、B、D、E四种元素分别与M元素形成的简单化合物中,沸点最高的是
H2O
H2O
(填化学式).(2)M、D、E、N形成的简单离子的半径由大到小的关系是(写离子符号)
S2->O2->Na+>H+
S2->O2->Na+>H+
.(3)A、B、D、M可组成多种18电子分子,请写出1种具有18电子的有机物的分子式
CH3OH
CH3OH
.(4)由A、D、N三种元素组成的无机物,其水溶液呈碱性,用离子方程式表示其原因
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.(5)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为
3:4
3:4
.(6)在由M、D、N、E四种元素构成的化合物的水溶液中滴入少量的Ba(OH)2溶液,写出可能发生的所有反应的离子方程式
2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O或2HSO3-+2OH-+Ba2+═BaSO3↓+2H2O+SO32-
2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O或2HSO3-+2OH-+Ba2+═BaSO3↓+2H2O+SO32-
.下列微粒中一定能促进水电离的是( )
| A、所有离子中,半经(径)最小的离子 | B、含1个原子核18电子的阴离子 | C、含1个原子核10电子的阳离子 | D、含有的电子数与质子数均与Na+相同,共含有5个原子核的微粒 |
下列微粒中一定能促进水电离的是
A.所有离子中,半经(径)最小的离子
B.含1个原子核18电子的阴离子
C.含1个原子核10电子的阳离子
D.含有的电子数与质子数均与Na 相同,共含有5个原子核的微粒
相同,共含有5个原子核的微粒
查看习题详情和答案>>
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻
的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)A、B、D、E四种元素分别与M元素形成的简单化合物中,沸点最高的是 (填化学式).
(2)M、D、E、N形成的简单离子的半径由大到小的关系是(写离子符号) .
(3)A、B、D、M可组成多种18电子分子,请写出1种具有18电子的有机物的分子式 .
(4)由A、D、N三种元素组成的无机物,其水溶液呈碱性,用离子方程式表示其原因 .
(5)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为 .
(6)在由M、D、N、E四种元素构成的化合物的水溶液中滴入少量的Ba(OH)2溶液,写出可能发生的所有反应的离子方程式 .
 查看习题详情和答案>>
查看习题详情和答案>>
的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)A、B、D、E四种元素分别与M元素形成的简单化合物中,沸点最高的是 (填化学式).
(2)M、D、E、N形成的简单离子的半径由大到小的关系是(写离子符号) .
(3)A、B、D、M可组成多种18电子分子,请写出1种具有18电子的有机物的分子式 .
(4)由A、D、N三种元素组成的无机物,其水溶液呈碱性,用离子方程式表示其原因 .
(5)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为 .
(6)在由M、D、N、E四种元素构成的化合物的水溶液中滴入少量的Ba(OH)2溶液,写出可能发生的所有反应的离子方程式 .
 查看习题详情和答案>>
查看习题详情和答案>>
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻
的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)A、B、D、E四种元素分别与M元素形成的简单化合物中,沸点最高的是______(填化学式).
(2)M、D、E、N形成的简单离子的半径由大到小的关系是(写离子符号)______.
(3)A、B、D、M可组成多种18电子分子,请写出1种具有18电子的有机物的分子式______.
(4)由A、D、N三种元素组成的无机物,其水溶液呈碱性,用离子方程式表示其原因______.
(5)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为______.
(6)在由M、D、N、E四种元素构成的化合物的水溶液中滴入少量的Ba(OH)2溶液,写出可能发生的所有反应的离子方程式______.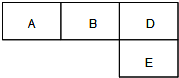
查看习题详情和答案>>
的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)A、B、D、E四种元素分别与M元素形成的简单化合物中,沸点最高的是______(填化学式).
(2)M、D、E、N形成的简单离子的半径由大到小的关系是(写离子符号)______.
(3)A、B、D、M可组成多种18电子分子,请写出1种具有18电子的有机物的分子式______.
(4)由A、D、N三种元素组成的无机物,其水溶液呈碱性,用离子方程式表示其原因______.
(5)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为______.
(6)在由M、D、N、E四种元素构成的化合物的水溶液中滴入少量的Ba(OH)2溶液,写出可能发生的所有反应的离子方程式______.
