网址:http://m.1010jiajiao.com/timu3_id_347587[举报]
按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为:
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
查看习题详情和答案>>
按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为: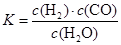
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。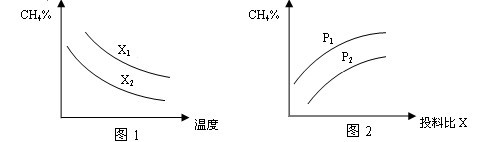
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为:
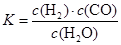
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
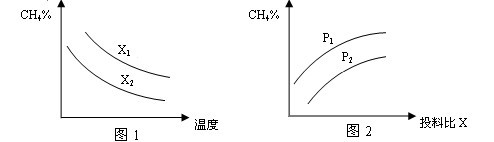
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
(15分).I下表是部分短周期元素的原子半径及主要化合价:
| 元素代号[ | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
 、化学式回答下列问题:
、化学式回答下列问题:(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有 ;
X可与W组成含18电子的化合物乙,则乙的电子式为 。
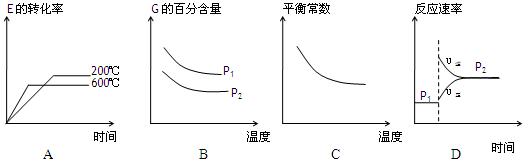
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g)
 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。 | p1(MPa) | P2(MPa) |
| 200 | 78.4 | 90.6 |
| 600 | 72.3 | 88.6 |
|
 II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。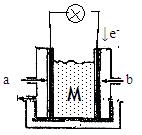
(1)若M为氢氧化钾溶液,
(2)若M为熔融的碳酸钾
(3)若M为传递O2-的固体电解质
III一定量的浓硝酸与足量的铁铜合金反应,硝酸被还原
为NO 、 NO2 、 N2O4 ,其标准状况下的体积均为112mL ,若向所得溶液中加入0.1mol/L的氢氧化钠溶液 mL恰好能使溶液中的金属离子沉淀完全。 查看习题详情和答案>>
| 元素代号[ | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
 、化学式回答下列问题:
、化学式回答下列问题:(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有 ;
X可与W组成含18电子的化合物乙,则乙的电子式为 。
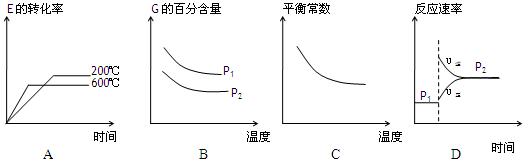
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g)
 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。 | p1(MPa) | P2(MPa) |
| 200 | 78.4 | 90.6 |
| 600 | 72.3 | 88.6 |
|
 II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由 极(填a或b)通入,写出下列条件下负极电极反应方程式。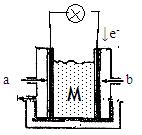
(1)若M为氢氧化钾溶液,
(2)若M为熔融的碳酸钾
(3)若M为传递O2-的固体电解质
III一定量的浓硝酸与足量的铁铜合金反应,硝酸被还原
为NO 、 NO2 、 N2O4 ,其标准状况下的体积均为112mL ,若向所得溶液中加入0.1mol/L的氢氧化钠溶液 mL恰好能使溶液中的金属离子沉淀完全。