摘要:例1. 7.5gMg.Al合金投入到200Ml5mol·L-1的盐酸中.使其完全溶解.然后逐滴加入4mol·L-1NaOH溶液.问当加入NaOH溶液多少mL时产生沉淀的质量最大? 解析:要使沉淀质量最大.即Mg(OH)2和Al(OH)3沉淀完全时.此时溶液中酸或碱均不能过量.溶液中溶质仅为NaCl.根据Na+.Cl-的来源及守恒原理可知: HCl - NaOH - NaCl 1mol 1mol 0.2L×5mol/L VL×4mol/L 即 0.2×5=V×4. V=0.25L=250mL 此类方法我们称之为“终态求解法 .抓住某个状态的特征.不追究具体过程.此法可大大简化解题过程. 例2.现有20g16%的氢氧化钠溶液和20mL 2mol/L的硫酸.若用它们与足量的铝屑反应生成氢氧化铝.理论上最多可生成多少氢氧化铝? 解析:生成氢氧化铝有三个途径: (1)Al Al2(SO4)3 Al(OH)3 (2)Al NaAlO2 Al(OH)3 (3)Al Al2(SO4)3 Al NaAlO2 通过比较可以确定生成氢氧化铝最多的方法为(3) n=0.08mol n(H2SO4)=0.04MOL NaOH - Al -NaAlO2 0.08mol 0.08mol H2SO4 - Al - Al2(SO4)3 - Al3+ 0.04mol mol Al3+ + 3AlO2- + 6H2O = 4Al(OH)3 1mol 3mol 4mol mol 0.08mol mol 恰好反应 m[Al(OH)3]= mol×78g/mol =8.32g 答:理论上最多可Al(OH)38.32g 巩固练习
网址:http://m.1010jiajiao.com/timu3_id_347218[举报]
酸、碱指示剂本身就是弱酸或弱碱,滴定操作时,酸(碱)首先和被滴定的碱(酸)反应,而后过量酸(碱)和指示剂作用变色,显然指示剂的酸碱性较弱. 沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度
若用AgNO3去滴定NaSCN溶液,可选用为滴定的指示剂的物质为
A.NaCl B.BaBr2 C.NaSCN D.Na2CrO4
达到滴定终点时的现象为
查看习题详情和答案>>
小
小
(填大、小、相同),否则不能用这种指示剂.| AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN | |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度mol/L | 1.8×10-10 | 7.1×10-7 | 1.1×10-8 | 1.9×10-12 | 1.0×10-6 |
D
D
A.NaCl B.BaBr2 C.NaSCN D.Na2CrO4
达到滴定终点时的现象为
混合物中有砖红色沉淀生成
混合物中有砖红色沉淀生成
.(2012?湖南模拟)2011年8月12日,网传云南曲靖市越州镇约5000余吨的重毒化工废料铬渣非法丢放,毒水被直接排放到南盘江中.被污染的水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强.
Ⅰ.污泥中Cr+回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
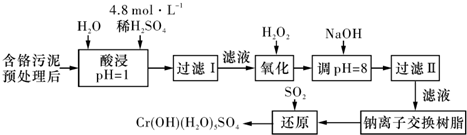
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4mol?L-1的浓硫酸配制250mL 4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需
(2)加入H2O2的作用是
(3)还原过程发生以下反应,请配平:
Na2SO4
Ⅱ.工业废水中常含有一定量的Cr2
和Cr
,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法,该法用Fe做电极,电解含Cr2
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.
阳极的电极反应式为
电解时能否用Cu电极来代替Fe电极?
查看习题详情和答案>>
Ⅰ.污泥中Cr+回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | _ | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
250mL容量瓶、胶头滴管.
250mL容量瓶、胶头滴管.
(2)加入H2O2的作用是
将滤液Ⅰ中的Cr3+转化为Cr2O72-,以便于与杂质离子分离
将滤液Ⅰ中的Cr3+转化为Cr2O72-,以便于与杂质离子分离
.调节溶液的pH=8是为了除去Fe3+、Al3+
Fe3+、Al3+
离子.(3)还原过程发生以下反应,请配平:
1
1
Na2Cr2O7+3
3
SO2+11
11
H2O
H2O
═2
2
Cr(OH)(H2O)5 SO4+Na2SO4
Na2SO4
Na2SO4
Ⅱ.工业废水中常含有一定量的Cr2
| O | 2- 7 |
| O | 2- 4 |
| O | 2- 7 |
阳极的电极反应式为
Fe-2e-═Fe2+
Fe-2e-═Fe2+
.电解时能否用Cu电极来代替Fe电极?
不能
不能
(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态
因阳极产生的Cu2+不能使Cr2O72-还原到低价态
.甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:
已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体.
(1)甲、乙、丙的化学式分别为
(2)25℃时,pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为 .
(3)写出⑤中发生反应的离子方程式
(4)25℃时,将a mol/L CH3COOH溶液与0.02mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)= (忽略混合时溶液体积的变化).
(5)等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,则乙溶液和丙溶液的体枳比可能为 (填选项字母).
A.3:1 B.1:3 C.7:1 D.1:7.
查看习题详情和答案>>
| 阳离子 | Na+、Mg2+、Fe3+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO32-、OH-、CO32-、SO42- |
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加入盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体.
(1)甲、乙、丙的化学式分别为
(2)25℃时,pH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为
(3)写出⑤中发生反应的离子方程式
(4)25℃时,将a mol/L CH3COOH溶液与0.02mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)=
(5)等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该元素的质量相等,则乙溶液和丙溶液的体枳比可能为
A.3:1 B.1:3 C.7:1 D.1:7.
现有下列短周期元素性质的数据:
回答下列问题:
(1)元素③在周期表中位置是
(2)元素①是
(3)元素⑤与元素②的非金属性强弱顺序为
(4)用电子式表示元素①氢化物的形成过程
 ;写出元素⑦氢化物的电子式
;写出元素⑦氢化物的电子式
 ;写出实验室制元素⑤单质的化学反应方程式
;写出实验室制元素⑤单质的化学反应方程式
查看习题详情和答案>>
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) |
0.74 | 1.02 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最 低化合价 |
+6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
(1)元素③在周期表中位置是
第二周期ⅠA族
第二周期ⅠA族
; 元素④与元素⑦相比较,气态氢化物较稳定的是NH3
NH3
(填化学式);(2)元素①是
O
O
(写元素符号),元素⑥是Na
Na
(写元素符号),二者按照原子个数比为1:1形成的化合物与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;(3)元素⑤与元素②的非金属性强弱顺序为
Cl>S
Cl>S
(写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为Cl2+H2S=2HCl+S↓
Cl2+H2S=2HCl+S↓
;(4)用电子式表示元素①氢化物的形成过程




MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2009?江苏)废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ?mol-12H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ?mol-1H2(g)+
O2(g)═H2O(l)H=-285.84KJ?mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol?L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是
查看习题详情和答案>>
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
BD
BD
(填字母).A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ?mol-12H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ?mol-1H2(g)+
| 1 |
| 2 |
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1
.(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol?L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
H2O2分解速率加快
H2O2分解速率加快
.(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是
2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+
2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+
.