网址:http://m.1010jiajiao.com/timu3_id_347176[举报]
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。

有关氢氧化物沉淀的pH见下表:
金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀的pH |
Fe3+ | 1.9 | 3.2 |
Mg2+ | 9.4 | 11.6 |
请回答下列问题:
(1)滤液A中含有的阳离子有 。
(2)操作②中涉及的化学方程式为 ,
操作④中生成沉淀G的离子方程式为 。
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号) 。
a. NaOH溶液 b. 氨水 c. MgO d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
|
流程中由MgCl2冶炼Mg的方法是 。在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是 。
查看习题详情和答案>>二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。

(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
氢氧化物 | Fe(OH)3 | A1(OH)3 |
开始沉淀pH | 1.5 | 3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是 ,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H =393.5 kJ?mol-l
②CO(g)+ O2(g)==CO2(g); △H =-283 kJ?mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H =141 kJ?mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
查看习题详情和答案>>X、Y、Z、W有如右图所示的转化关系,且△H=△H1+△H2,则X、Y可能是( )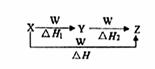
①C、CO ②S、SO2 ③AlCl3、Al(OH)3
④Na2CO3、NaHCO3 ⑤Fe、FeCl2
A.①②③④⑤ B.②④⑤ C.①③④ D.①②③
查看习题详情和答案>>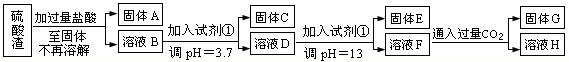
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol?L-1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:
(2)上述流程中两次使用试剂①,推测试剂①应该是
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
(4)固体E为
(5)计算溶液F中c(Mg2+)=
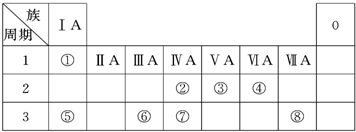
(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式


(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |
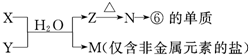
X溶液与Y溶液反应的离子方程式
N→⑥的单质的化学方程式为
| ||
| 冰晶石 |
| ||
| 冰晶石 |
M溶液中离子浓度由大到小的排列顺序是
M中阳离子的鉴定方法