摘要:在反应5H2O + 3BrF3 = Br2 + O2↑+ HBrO3 + 9HF中.当有45克水被氧化时.被子水还原的BrF3的物质的量是 A.5/3 mol B.5/2 mol C.3/2 mol D.4/3 mol
网址:http://m.1010jiajiao.com/timu3_id_34677[举报]
反应A+3B═2C+2D在四种不同情况下的反应速率分别为:( )
①v(A)=0.15mol?L-1?s-1 ②v(B)=0.6mol?L-1?s-1 ③v(C)=0.4mol?L-1?s-1 ④v(D)=0.45mol?L-1?s-1.该反应进行的快慢顺序为.
①v(A)=0.15mol?L-1?s-1 ②v(B)=0.6mol?L-1?s-1 ③v(C)=0.4mol?L-1?s-1 ④v(D)=0.45mol?L-1?s-1.该反应进行的快慢顺序为.
查看习题详情和答案>>
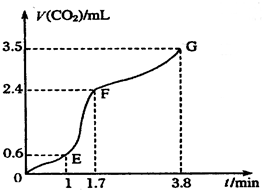 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:(1)写出发生反应的离子方程式
CaCO3+2H+=Ca2++H2O+CO2↑
CaCO3+2H+=Ca2++H2O+CO2↑
;(2)实验过程中绘制出生成CO2的体积[V(CO2)]与时间(t)的关系如图所示,试分析判断OE段、EF段、FG段反应速率(分别用υ(OE)、υ(EF)、υ(FG)表示)哪个最快
υ(EF)
υ(EF)
;比较OE段和EF段,说明EF段速率变化的主要原因可能是
温度较高、浓度较大
温度较高、浓度较大
Ⅱ反应A+3B=2C+2D.在四种不同的情况下的反应速率分别为:
①υ(A)=0.15mol/(L?s) ②υ(B)=0.6mol/(L?s)
③υ(C)=0.4mol/(L?s) ④υ(D)=0.45mol/(L?s)
该反应进行的快慢顺序为
④>②=③>①
④>②=③>①
.在一个固定容积的密闭容器中,保持一定的温度进行以下反应:
A(g)+3B(g) 3C(g),已知加入1molA和3molB,平衡时A的物质的量为a mol.
3C(g),已知加入1molA和3molB,平衡时A的物质的量为a mol.
(1)达到平衡时C在反应混合体中体积百分含量是
×100%
×100%(用含a的关系式表示)
(2)在相同的实验条件下,若在同一个容器中改为加入2molA和6molB,达到平衡后,C在混合气体中的体积百分含量
(3)若在同一个容器中改为加入2molA和6molB,能否通过调节C的物质的量,使平衡时C在混合气体中的百分含量与原平衡相同?
(4)在相同的实验条件下,如果加入n mol A、m mol B和p molC,若要求平衡后C在混合气体中的百分含量保持不变,与(1)相同,则n、m与p的关系式为
查看习题详情和答案>>
A(g)+3B(g)
 3C(g),已知加入1molA和3molB,平衡时A的物质的量为a mol.
3C(g),已知加入1molA和3molB,平衡时A的物质的量为a mol.(1)达到平衡时C在反应混合体中体积百分含量是
| (3-3a) |
| (3+a) |
| (3-3a) |
| (3+a) |
(2)在相同的实验条件下,若在同一个容器中改为加入2molA和6molB,达到平衡后,C在混合气体中的体积百分含量
增大
增大
(填“增大”“减小”或“不变”).(3)若在同一个容器中改为加入2molA和6molB,能否通过调节C的物质的量,使平衡时C在混合气体中的百分含量与原平衡相同?
能,移走3molC.
能,移走3molC.
(如果能,请写出C的物质的量,如不能,请说明通过什么方法可以实现.)(4)在相同的实验条件下,如果加入n mol A、m mol B和p molC,若要求平衡后C在混合气体中的百分含量保持不变,与(1)相同,则n、m与p的关系式为
n+
=1,m+p=31,m=3n
| p |
| 3 |
n+
=1,m+p=31,m=3n
.| p |
| 3 |