摘要:在溶有FeSO4和CuSO4的溶液中加入锌粉, 下列说法中不正确的是 (A)若锌粉无剩余, 且溶液中尚存有Cu2+, 则一定有Fe2+ (B)若锌粉有剩余, 则溶液中只有Fe2+ (C)若锌粉有剩余, 则溶液中只有Zn2+ (D)若锌粉无剩余, 且溶液中无Cu2+, 则一定有Zn2+, 但不能确定有无Fe2+
网址:http://m.1010jiajiao.com/timu3_id_346744[举报]
水是生命之源,广西重金属镉污染事件是2012年1月15日发现的.水污染事件再次提醒人们保护水资源的必要性和紧迫性.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法.
该法的工艺流程为:
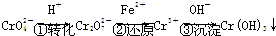
其中第①步存在平衡:
2CrO
(黄色)+2H+?Cr2O
(橙色)+H2O
(1)若平衡体系的 pH=2,该溶液显 色.
(2)能说明第①步反应达平衡状态的是 .(填序号)
A.Cr2O
和CrO
的浓度相同
B.2v(Cr2O
)=v(CrO
)
C.溶液的颜色不变
(3)第②步中,还原 1mol Cr2O72-离子,需要 mol的FeSO4?7H2O.
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至 .
方法2:电解法.
该法用 Fe 做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生 Cr(OH)3 沉淀.
(5)用Fe做电极的原因为 (用电极反应式解释).
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有 .(用化学式表示)
(7)溶液中发生的总反应为(用离子方程式表示) .
查看习题详情和答案>>
方法1:还原沉淀法.
该法的工艺流程为:
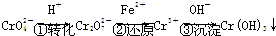
其中第①步存在平衡:
2CrO
2- 4 |
2- 7 |
(1)若平衡体系的 pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O
2- 7 |
2- 4 |
B.2v(Cr2O
2- 7 |
2- 4 |
C.溶液的颜色不变
(3)第②步中,还原 1mol Cr2O72-离子,需要
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至
方法2:电解法.
该法用 Fe 做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生 Cr(OH)3 沉淀.
(5)用Fe做电极的原因为
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有
(7)溶液中发生的总反应为(用离子方程式表示)
工业废水中常含有一定量的Cr2O
和CrO
,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法
该法的工艺流程为:CrO
Cr2O
Cr3+
Cr(OH)3↓
其中第①步存在平衡:2CrO
(黄色)+2H+?Cr2O
(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
a.Cr2O
和CrO
的浓度相同
b.2v(Cr2O
)=v(CrO
)
c.溶液的颜色不变
(3)第②步中,还原1molCr2O
离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)??Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
方法2:电解法
该法用Fe做电极电解含Cr2O
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe作电极的原因为
(6)在阴极附近溶液PH升高的原因是(用电极方程式解释)
查看习题详情和答案>>
2- 7 |
2- 4 |
方法1:还原沉淀法
该法的工艺流程为:CrO
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
其中第①步存在平衡:2CrO
2- 4 |
2- 7 |
(1)若平衡体系的pH=2,该溶液显
橙
橙
色.(2)能说明第①步反应达平衡状态的是
c
c
.a.Cr2O
2- 7 |
2- 4 |
b.2v(Cr2O
2- 7 |
2- 4 |
c.溶液的颜色不变
(3)第②步中,还原1molCr2O
2- 7 |
6
6
mol的FeSO4?7H2O.(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)??Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
5
5
.方法2:电解法
该法用Fe做电极电解含Cr2O
2- 7 |
(5)用Fe作电极的原因为
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
.(6)在阴极附近溶液PH升高的原因是(用电极方程式解释)
2H++2e-═H2↑
2H++2e-═H2↑
.已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定.以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图.根据下图回答:

(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):
(4)步骤3中,加入(NH4)2SO4固体后,应加热到
(5)抽滤装置的仪器有:
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
②本实验的指示剂
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于
④终点颜色的变化:
⑤产品中Fe2+的质量分数为
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:
查看习题详情和答案>>

(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:
CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
AB
AB
:A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.步骤2中溶液趁热过滤的原因是防止溶液冷却时,硫酸亚铁因析出而损失
防止溶液冷却时,硫酸亚铁因析出而损失
.(4)步骤3中,加入(NH4)2SO4固体后,应加热到
溶液表面出现晶膜
溶液表面出现晶膜
时,停止加热.需经过的实验操作包括:蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、减压过滤(或抽滤)等得到较为干燥
干燥
的晶体.(5)抽滤装置的仪器有:
布氏漏斗
布氏漏斗
、抽滤瓶
抽滤瓶
、安全瓶、抽气泵组成.(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
5
5
Fe2++1
1
MnO4-+8H+
8H+
=1
1
Mn2++5
5
Fe3++4
4
H2O②本实验的指示剂
D
D
.A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于
酸式
酸式
(酸式、碱式)滴定管中④终点颜色的变化:
溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点
溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点
.⑤产品中Fe2+的质量分数为
14%
14%
.(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:
a<b<c
a<b<c
.(用a,b,c回答)(2013?大连模拟)下列有关化学实验操作合理的是( )
①在配铜FeSO4溶液时常向其中加入一定量铁粉和稀硫酸
②配制100mL 1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体.
③物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
④用试管夹从试管底由下往上夹住距试管口约
处,手持试管夹长柄末端,进行加热
⑤不慎将浓硫酸沾在皮肤上,立即用NaHCO3溶液冲洗
⑥用广泛pH试纸测得某溶液的pH=12.3
⑦用碱式滴定管量取20.00mL 0.100 0mol/L KMnO4溶液
⑧铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜.
①在配铜FeSO4溶液时常向其中加入一定量铁粉和稀硫酸
②配制100mL 1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体.
③物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
④用试管夹从试管底由下往上夹住距试管口约
| 1 |
| 3 |
⑤不慎将浓硫酸沾在皮肤上,立即用NaHCO3溶液冲洗
⑥用广泛pH试纸测得某溶液的pH=12.3
⑦用碱式滴定管量取20.00mL 0.100 0mol/L KMnO4溶液
⑧铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜.
查看习题详情和答案>>
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.其中一种方法是还原沉淀法
该法的工艺流程为:CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓
其中第步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
查看习题详情和答案>>
该法的工艺流程为:CrO42-
| H+ |
| ①转化 |
| Fe3+ |
| ②还原 |
| OH- |
| ③沉淀 |
其中第步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显
橙
橙
色.(2)能说明第①步反应达平衡状态的是
C
C
.A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
6
6
mol的FeSO4?7H2O.写出第②步中反应的离子方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
.(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
5
5
.