摘要:周期表中.有人认为位于第IA族的氢元素.也可以放在ⅦA族.下列物质支持这种观点的是 ( ) A. HF B. H3O+ C. NaH D. H2O2
网址:http://m.1010jiajiao.com/timu3_id_346335[举报]
(2011?上饶二模)如图是金字塔式元素周期表的一部分(元素周期表的另一种画法),图上标有第VIA族和几种元素的位置.请回答下列问题:
(1)请在上图中描出金属与非金属的分界线,并将铁元素所在族的位置全部涂黑.
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第VIIA族,理由是:氢的最外层电子“饱和缺一”.请用电子式表示LiH:
(3)f与c或g均能形成一些化合物,据有关材料f与c能形成化合物fC6,f能与g形成化合物f2g.请回答下面问题:
①甲同学通过分析认为fC6此物质不可在O2中燃烧,原因是
②乙同学通过分析认为F2g2是分子晶体,试写出其结构简式:
 ;
;
该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式:
(4)a和f形成化合物a2f,a2f分子中f原子轨道的杂化类型为
(5)下列叙述正确的是
A.h的最高价氧化物对应的水化物是一种强碱.
B.硒化氢的稳定性强于f的氢化物的稳定性.
C.c与h形成化合物的水溶液显中性.
D.离子半径:f>g>h>d
E.f与d形成离子化合物为电解质,故该晶体能导电.
F.a、d、e常见氧化物熔沸点高低比较:e>d>a.
查看习题详情和答案>>

(1)请在上图中描出金属与非金属的分界线,并将铁元素所在族的位置全部涂黑.
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第VIIA族,理由是:氢的最外层电子“饱和缺一”.请用电子式表示LiH:
Li+[:H]-
Li+[:H]-
.(3)f与c或g均能形成一些化合物,据有关材料f与c能形成化合物fC6,f能与g形成化合物f2g.请回答下面问题:
①甲同学通过分析认为fC6此物质不可在O2中燃烧,原因是
SF6中S元素显+6价不可再升,氧气不能将-1价氟氧化
SF6中S元素显+6价不可再升,氧气不能将-1价氟氧化
.②乙同学通过分析认为F2g2是分子晶体,试写出其结构简式:


该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液.试写出该过程的反应方程式:
2S2Cl2+2H2O=3S+SO2↑+4HCl
2S2Cl2+2H2O=3S+SO2↑+4HCl
.(4)a和f形成化合物a2f,a2f分子中f原子轨道的杂化类型为
sp3
sp3
,a2f分子空间构型为V型
V型
.(5)下列叙述正确的是
ADF
ADF
A.h的最高价氧化物对应的水化物是一种强碱.
B.硒化氢的稳定性强于f的氢化物的稳定性.
C.c与h形成化合物的水溶液显中性.
D.离子半径:f>g>h>d
E.f与d形成离子化合物为电解质,故该晶体能导电.
F.a、d、e常见氧化物熔沸点高低比较:e>d>a.
(2009?上海一模)有机物F商品名称“敌稗(Propanil)”,是一种优良的水稻除草剂,现通过下列合成路线制备:
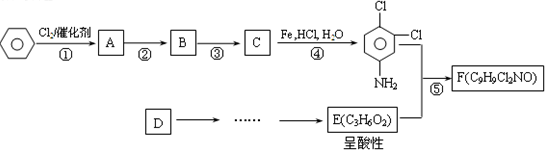
已知:
Ⅰ.RX
RCN
RCOOH (X表示卤素原子,下同)
Ⅱ.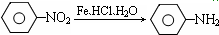
Ⅲ.当一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而取代邻位、对位或间位.使新的取代基进入它的邻位、对位的取代基:-CH3、-NH2、-X;使新的取代基进入它的间位的取代基有:-COOH、-NO2等.
请结合上述所给信息,回答问题:
(1)反应②的化学反应方程式: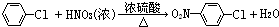
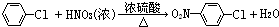 .
.
(2)有人认为:若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的.请你指出不妥之处
(3)反应⑤的化学反应方程式:
 .
.
(4)请你设计D→E(C3H6O2)的合成路线.
要求:①合成过程中无机试剂任选、有机原料碳原子不超过2个;②合成反应流程图表示方法示例如下:A
B
C…→D.
查看习题详情和答案>>

已知:
Ⅰ.RX
| NaCN |
| H2O |
Ⅱ.
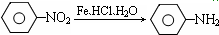
Ⅲ.当一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而取代邻位、对位或间位.使新的取代基进入它的邻位、对位的取代基:-CH3、-NH2、-X;使新的取代基进入它的间位的取代基有:-COOH、-NO2等.
请结合上述所给信息,回答问题:
(1)反应②的化学反应方程式:
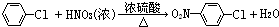
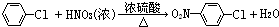
(2)有人认为:若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的.请你指出不妥之处
所得C的纯度不高
所得C的纯度不高
.(3)反应⑤的化学反应方程式:


(4)请你设计D→E(C3H6O2)的合成路线.
要求:①合成过程中无机试剂任选、有机原料碳原子不超过2个;②合成反应流程图表示方法示例如下:A
| ||
| 反应条件 |
| ||
| 反应条件 |
(《物质结构与性质》)
(1)金属镁有许多重要的用途,法国化学家维多克?格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:
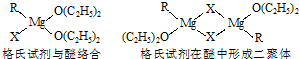
①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出 .
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为 ;Mg原子的核外电子排布式可表示为 .
③下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
Ti+2MgCl2
①Ti元素在元素周期表中的位置是 ,钛原子的外围电子排布式为 .
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于 (填“原子”、“分子”或“离子”)晶体.
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是 .
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键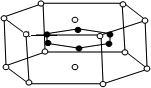
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2.
查看习题详情和答案>>
(1)金属镁有许多重要的用途,法国化学家维多克?格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:

①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为
③下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
| ||
①Ti元素在元素周期表中的位置是
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键

(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2.
(1)在如图的元素周期表p区中画出金属元素与非金属元素的分界线.
(2)根据NaH的存在,有人提议可将氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的
(3)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
(4)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如表:
①Y位于元素周期表位置
②XY2是一种常用的溶剂,请写出它的电子式
 ,XY2的分子中存在
,XY2的分子中存在
③Y有两种氧化物其化学式为YO2和YO3,其中YO3中Y原子采用
④W的基态原子核外电子排布式是
查看习题详情和答案>>

(2)根据NaH的存在,有人提议可将氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的
ⅣA
ⅣA
族.(3)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
5
5
种.(4)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如表:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
第3周期、第ⅥA族
第3周期、第ⅥA族
,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4
HClO4
(写化学式).②XY2是一种常用的溶剂,请写出它的电子式


2
2
个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Z
H-Z
.③Y有两种氧化物其化学式为YO2和YO3,其中YO3中Y原子采用
sp2
sp2
杂化,YO2分子的空间构型V形
V形
.④W的基态原子核外电子排布式是
[Ar]3d104s1
[Ar]3d104s1
.现有含W2+的配合物,化学式为[W(H2O)4]SO4?H2O.该配合物中含有的化学键类型配位键、共价键和离子键
配位键、共价键和离子键
,该配合物的配体是H2O
H2O
.下表中所列的是8种短周期元素原子的半径及主要化合价:
(1)C元素在周期表中的位置为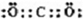
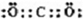 ,G元素最低价氢化物的空间构型为
,G元素最低价氢化物的空间构型为
(2)B、D、E所代表元素的离子半径从大到小的顺序为
(3)C与E形成的化合物属于
(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式:
(5)有人认为:H-E键的键能大于H-L键的键能,所以H2E的沸点高于H2L的沸点.你是否赞同这种观点
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E | G | L | I |
| 原子半径/nm | 0.111 | 0.064 | 0.117 | 0.16 | 0.066 | 0.070 | 0.104 | 0.077 |
| 主要化合价 | +2 | -1 | +4,-4 | +2 | -2 | +5.-3 | +6,-2 | +4,-4 |
第三周期ⅣA族
第三周期ⅣA族
;IE2的电子式为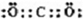
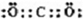
三角锥型
三角锥型
.(2)B、D、E所代表元素的离子半径从大到小的顺序为
O2->F->Mg2+
O2->F->Mg2+
(填离子符号).G、C最高价氧化物对应水化物的酸性强弱关系为(写化学式)HNO3>H2SiO3
HNO3>H2SiO3
.(3)C与E形成的化合物属于
原子
原子
晶体.(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式:
Be+2OH-═BeO22-+H2↑
Be+2OH-═BeO22-+H2↑
.(5)有人认为:H-E键的键能大于H-L键的键能,所以H2E的沸点高于H2L的沸点.你是否赞同这种观点
不赞同
不赞同
(填“赞同”或“不赞同”),理由:H2O与H2S所成晶体为分子晶体,H2O的熔沸点高于H2S的熔沸点与键能无关
H2O与H2S所成晶体为分子晶体,H2O的熔沸点高于H2S的熔沸点与键能无关
.