摘要:42. 15.在NH3.HNO3.H2SO4的工业生产中.具有的共同点是 (A) 使用吸收塔设备 (B) 使用尾气吸收装置 (C) 使用H2作原料 (D) 使用催化剂
网址:http://m.1010jiajiao.com/timu3_id_346299[举报]
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4G.HClO.以上物质中属于非电解质的是
ABE
ABE
;属于强电解质的是DF
DF
.(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1<
<
m2(填“<”、“=”、“>”)(3)在25℃时,有pH为a(a≤6)的盐酸和pH为b(b≥8)的NaOH溶液,取Va L该盐酸,与该NaOH溶液中和,需Vb LNaOH溶液.若a+b>15,则Va:Vb=
10a+b-14
10a+b-14
(填表达式),且Va>
>
Vb(填“>”、“<”或“=”).(4)已知:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-.现有浓度为0.1mol?L-1的五种溶液:
A.Na2CO3;B.NaHCO3;C.NaAlO2;D.CH3COONa;E.NaOH.
这五种溶液的pH由小到大的顺序是
DBACE
DBACE
(填编号)(5)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液.该溶液中存在的三个平衡体系,它们是:水的电离H2O?H++OH-、
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
、NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
(用电离或离子方程式表示);在此溶液中浓度为0.01mol/L的微粒是Cl-
Cl-
,浓度为0.002mol/L的微粒是Na+
Na+
;NH4+
NH4+
和H+
H+
两种微粒的物质的量之和比OH-多0.008mol.(2008?广东)醇氧化成醛的反应是药物、香料合成中的重要反应之一.
(1)苯甲醇可由C6H5CH2Cl在NaOH水溶液中发生取代反应而得,反应方程式为
 .
.
(2)醇在催化剂作用下氧化成醛的反应是绿色化学的研究内容之一.某科研小组研究了把催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K2CO3、363K、甲苯(溶剂).实验结果如下:
分析表中数据,得到把催化剂催化效果的主要结论是
(3)用空气代替氧气气氛进行苯甲醇氧化生成苯甲醛的反应,其他条件相同,产率达到95%时的反应时间为7.0小时.请写出用空气代替氧气气氛进行反应的优缺点:
(4)苯甲醛易被氧化.写出苯甲醛被银氨溶液氧化的反应方程式
(5)在药物、香料合成中常利用醛和醇反应生成缩醛来保护醛基,此类反应在酸催化下进行.例如:
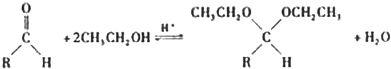
①在以上醛基保护反应中要保证反应的顺利进行,可采取的措施有
②已知具有五元环和六元环结构的缩醛比较稳定.写出用乙二醇(HOCH2CH3OH)保护苯甲醛中醛基的反应方程式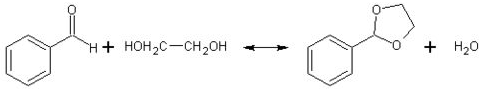
 .
.
查看习题详情和答案>>
(1)苯甲醇可由C6H5CH2Cl在NaOH水溶液中发生取代反应而得,反应方程式为


(2)醇在催化剂作用下氧化成醛的反应是绿色化学的研究内容之一.某科研小组研究了把催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K2CO3、363K、甲苯(溶剂).实验结果如下:
| 醇 | 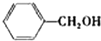 |
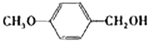 |
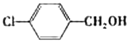 |
| 反应时间/h | 2.5 | 2.5 | 2.5 |
| 醛的产率/% | 95 | 96 | 94 |
| 醇 | 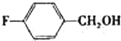 |
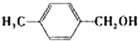 |
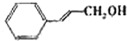 |
| 反应时间/h | 3.0 | 3.0 | 15.0 |
| 醛的产率/% | 95 | 92 | 40 |
苯环上的取代基对醛的产率影响不大,对反应时间有一定影响及与羟基相连的碳链长,大大降低醛的产率与增大反应时间
苯环上的取代基对醛的产率影响不大,对反应时间有一定影响及与羟基相连的碳链长,大大降低醛的产率与增大反应时间
(写出2条).(3)用空气代替氧气气氛进行苯甲醇氧化生成苯甲醛的反应,其他条件相同,产率达到95%时的反应时间为7.0小时.请写出用空气代替氧气气氛进行反应的优缺点:
优点为原料易得,降低成本,防止苯甲醛氧化为苯甲酸;缺点为令反应时间增长
优点为原料易得,降低成本,防止苯甲醛氧化为苯甲酸;缺点为令反应时间增长
.(4)苯甲醛易被氧化.写出苯甲醛被银氨溶液氧化的反应方程式
C6H5CHO+2Ag(NH3)2OH
C6H5COONH4+2Ag↓+3NH3↑+H2O
| 水浴加热 |
C6H5CHO+2Ag(NH3)2OH
C6H5COONH4+2Ag↓+3NH3↑+H2O
(标出具体反应条件).| 水浴加热 |
(5)在药物、香料合成中常利用醛和醇反应生成缩醛来保护醛基,此类反应在酸催化下进行.例如:
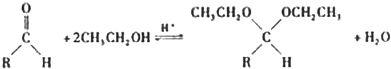
①在以上醛基保护反应中要保证反应的顺利进行,可采取的措施有
CH3CH2OH过量,令化学平衡向正反应方向移动或边反应边蒸馏缩醛脱离反应体系,令化学平衡向正反应方向移动
CH3CH2OH过量,令化学平衡向正反应方向移动或边反应边蒸馏缩醛脱离反应体系,令化学平衡向正反应方向移动
(写出2条).②已知具有五元环和六元环结构的缩醛比较稳定.写出用乙二醇(HOCH2CH3OH)保护苯甲醛中醛基的反应方程式


 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.A.[物质结构]
[Cu(NH3)4]SO4?H2O是一种杀虫剂.
(1)Cu元素基态原子的电子排布式为
(2)元素N、O、S的第一电离能由大到小排列的顺序为
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为
(5)与S
| O | 2- 4 |
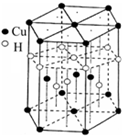
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为
B.[实验化学]
目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的.利用废聚酯饮料瓶制备对苯二甲酸的反应原理如下:
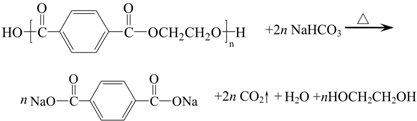
实验过程如下:
步骤1:在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计.依次加入5g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇.缓慢搅拌,油浴加热,升温至180℃,反应15分钟.
步骤2:冷却至160℃停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.
步骤3:向四颈瓶中加入50mL沸水,搅拌使残留物溶解.抽滤除去少量不溶物.
步骤4:将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL,加入沸石,将烧杯置于石棉网上加热煮沸.
步骤5:取下烧杯,取出沸石后趁热边搅拌边用8~10mL 1:1HCl酸化,酸化结束,体系呈白色浆糊状.
步骤6:冷至室温后再用冰水冷却.抽滤,滤饼用蒸馏水洗涤数次至滤出液pH=6,抽干后再用10mL丙酮分2次洗涤,抽干,干燥.
(1)步骤1反应过程中的现象是
(2)步骤2是为了分离出
(3)步骤3抽滤需要用到的主要仪器有
(4)步骤4加沸石的目的是
(5)步骤5用盐酸酸化的目的是
(6)步骤6用丙酮洗涤的目的是
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中,N2+3H2
2NH3△H<0
①该反应的平衡常数K的表达式为:K=
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
表中数据,
③下列关于合成氨说法正确是
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式
查看习题详情和答案>>
(1)传统哈伯法合成氨工艺中,N2+3H2
| 催化剂 |
| 高温 |
①该反应的平衡常数K的表达式为:K=
=
| c2(NH3) |
| c(N2)?c3(NH3) |
=
.升高温度,K值| c2(NH3) |
| c(N2)?c3(NH3) |
减小
减小
(填“增大”、“减小”或“不变”).②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
| 压强(Mpa) 氨的平衡含(%) 温度(摄氏度) |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
200
200
℃100
100
MPa时H2的转化率最高,实际工业生产不选用该条件的主要原因是压强太高,对生产设备要求也高,难以实现,且200℃时反应速率过低
压强太高,对生产设备要求也高,难以实现,且200℃时反应速率过低
.③下列关于合成氨说法正确是
C
C
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式
2NH3-6e-+6OH-=N2+6H2O
2NH3-6e-+6OH-=N2+6H2O
,你认为电解质溶液应显碱
碱
性(填“酸性”、“中性”、“碱性”),其原因是NH3在酸性介质中易转化为NH4+离子
NH3在酸性介质中易转化为NH4+离子
. (2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
BC
BC
.A.2v(NH3)=v(CO2)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:
1.6×10-8(mol/L)3
1.6×10-8(mol/L)3
.③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量
增加
增加
(填“增加”、“减小”或“不变”).④氨基甲酸铵分解反应的焓变△H
>
>
0,熵变△S>
>
0(填>、<或=).(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3?H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率
0.05mol/(L?min)
0.05mol/(L?min)
.⑥根据图中信息,如何说明水解反应速率随温度升高而增大:
25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
.