摘要: 在常温常压下.将a升SO2和b升H2S混合.当反应后气体体积是反应前气体体积的四 分之一时.则a与b之比是( ) ① 1:1 ② 1:2 ③ 1:3 ④ 2:1 ②.③ ①.③
网址:http://m.1010jiajiao.com/timu3_id_34628[举报]
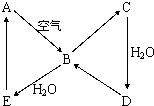 (2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
(2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.(1)写出A在加热条件下与H2反应的化学方程式
H2+S
H2S
| ||
H2+S
H2S
;
| ||
(2)写出E与A的氢化物反应生成A的化学方程式
H2SO3+2H2S═3S↓+3H2O
H2SO3+2H2S═3S↓+3H2O
;(3)写出一个由D生成B的化学方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O等
| ||
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O等
;
| ||
| ||
(4)将5mL 0.10mol?L-1的E溶液与10mL 0.10mol?L-1的NaOH溶液混合.
①写出反应的离子方程式
H2SO3+2OH-═SO32-+2H2O
H2SO3+2OH-═SO32-+2H2O
;②反应后溶液的pH
大于
大于
7(填“大于”、“小于”或“等于”),理由是Na2SO3溶液中SO32-发生水解使溶液显碱性
Na2SO3溶液中SO32-发生水解使溶液显碱性
;③加热反应后的溶液,其pH
增大
增大
(填“增大”、“不变”或“减小”),理由是升高温度促进Na2SO3溶液的水解
升高温度促进Na2SO3溶液的水解
.