网址:http://m.1010jiajiao.com/timu3_id_346015[举报]
将二氧化碳通入下列物质的溶液中不与其反应的是( )
①Na2CO3 ②Na2SiO3 ③NaAlO2 ④Ca(ClO)2 ⑤ CaCl2 ⑥CaCO3
A.①③④⑤ B.①和⑤ C.只有① D.只有⑤
查看习题详情和答案>> 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
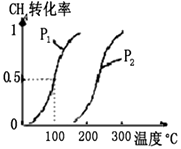
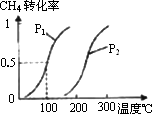
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
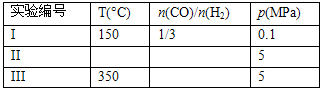
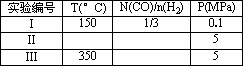
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
 ③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
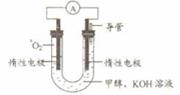
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看习题详情和答案>> 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
 写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看习题详情和答案>>①CH4(g)+H2O(g)
 CO(g)+3H2(g) △H
CO(g)+3H2(g) △H ②CO(g)+2H2(g)
 CH3OH(g) △H
CH3OH(g) △H 将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图:
(2)反应①的△H____ 0(填“<”“=”或“>”);100℃时的平衡常数值K= _______。
(3)在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-556.0 kJ/mol
③H2O(g)=H2O(l) △H3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 _________________。
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH-
 2CO32-+ 6H2O,放电时负极的电极反应方程为_______________________
2CO32-+ 6H2O,放电时负极的电极反应方程为_______________________ 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如下图.
(1)温度不变,缩小体积,①的逆反应速率________(填“增大”、“减小”或“不变”)
(2)反应①的ΔH1________0(填“<”“=”或“>”)100℃时的平衡常数值K=________.
(3)在压强为0.1 Mpa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下进行反应②再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
300℃时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是________(填字母)
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH2OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH=-556.0 kJ/mol
③H2O(g)=H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式________.
(5)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置.
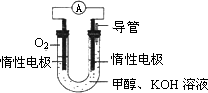
①该电池正极的电极反应为________.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
________.