网址:http://m.1010jiajiao.com/timu3_id_345678[举报]
(1)我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液。写出该电池负极的电极反应式_______________。
(2)下图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。该装置中________(填“a”或“b”)为电池的正极, 已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为 2CH3OH(g)+3O2(g)
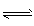 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。 
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________。
II:某温度下,向密闭容器中充入2.0 mol CO和1.0mol H2O,发生反应:
CO(g)+H2O(g)
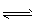 CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题:
CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题: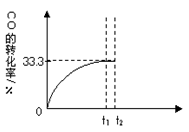
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量很小
D.该反应一定是放热反应
E.该反应使用催化剂意义不大
(5)t2时刻向平衡体系中再通入1.0 mol H2O(g),t3时刻重新建立平衡,请在原坐标图中将改变这一条件后CO的转化率的变化趋势表示出来,必须注明再次建立平衡后CO的转化率。
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。
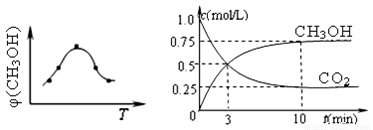
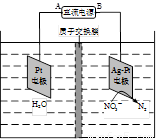
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H1=-574kJ•mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH) =1.5 mol/L
B.达到平衡时,氢气的转化率为0.75
C.0~10分钟内,氢气的平均反应速率为0.075mol/(L•min)
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)增大
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
查看习题详情和答案>>
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。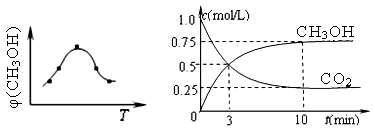
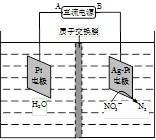
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min) |
| D.该温度下,反应的平衡常数的值为3/16 |
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。 查看习题详情和答案>>


图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min) |
| D.该温度下,反应的平衡常数的值为3/16 |
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
一、实验用品:纯锌片,铜片,37%的浓盐酸,蒸馏水,氯化铜溶液。
二、实验记录:
交流卡片 NO:2006—SY—518 主题:Zn,Cu与浓盐酸 A.将锌放入浓盐酸中,反应较快 B.将锌片与铜片贴在一起,一同投入浓盐酸中,反应快速放出气体 C.当B中锌片完全溶解后,将溶液加热,又产生气体(值得进一步探究),得到无色溶液 D.将上述反应后的溶液,隔绝空气,加入适量水,出现白色沉淀 |
三、提供资料:
资料卡片 NO:2006—ZL—918 主题:生成一价铜的反应 ①课本上:CH3CHO+2Cu(OH)2 ②盐城市第二次调研试卷:Cu2++4I-====2CuI(白色)↓+I2 ③《无机化学》下册,p788,氯化亚铜在不同浓度的KCl溶液中可形成[CuCl2]-、[CuCl3]2-、[CuCl4]3-等离子,且它们在溶液中均为无色。 |
四、请你参与以下探究:
(1)交流卡片中,实验A反应速率明显比B小,原因是:___________________________。
(2)根据铜位于金属活动顺序表氢之后,与稀盐酸不反应,依据交流卡片C又产生气体的事实。作出如下推断:
①有同学认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是:__________________。
②某同学作了如下猜想,是否成立,请你设计实验方案加以验证:
猜想 | 验证方法 | 预测现象及结论 |
认为铜片中可能含有锌等杂质 |
|
|
(3)交流卡片D中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会产生出沉淀。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个,只设计两个方案):
| 预设验证方法 | 预测的现象与结论 |
白色沉淀是氯化亚铜 |
|
|
|
|
(4)指导老师肯定了白色沉淀是氯化亚铜,请结合资料卡片③,写出铜与足量盐酸在加热条件下反应生成无色溶液及气体的化学方程式:___________________。根据交流卡片D,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系式:___________________(用离子方程式表示)。
(5)就铜与浓盐酸反应若还需进一步探讨,你认为还可探究的内容有:___________________(只提供一个实验课题即可)。