网址:http://m.1010jiajiao.com/timu3_id_345663[举报]
①H5IO6是
②已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,反应的离子方程式为
(2)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
①a值不可能等于3,其理由是
②a值可否等于5
③a的取值范围是
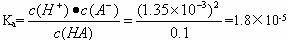
(1)恰好完全中和时(B点)溶液的pH_______7(填“>”“<”或“=”),理由是______________。
(2)当弱电解质AB在水溶液里达到平衡时:AB![]() A++B-,即有K电离=
A++B-,即有K电离=![]()
式中c(A+)·c(B-)、c(AB)分别表示粒子A+、B-、AB电离平衡时的物质的量浓度,K电离是弱电解质的电离平衡常数,简称电离常数,一定温度下,电离常数不随溶液浓度改变而改变,通过上述材料的阅读,求本题中一元弱酸的电离常数。
(3)求A点的pH。(lg1.35=0.13 lg1.8=0.26)
查看习题详情和答案>>实验编号 | HCl物质的量浓度(mol·L-1) | BOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | 0.2 | c1 | pH=7 |
丙 | 0.1 | 0.2 | pH<7 |
丁 | 0.1 | 0.1 | pH=5 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明BOH是强碱还是弱碱_____________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1____________(选填“是”或“否”)。混合溶液中离子浓度c(B+)与c(Cl-)的大小关系是____________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,BOH是____________酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是____________。
(4)丁组实验所得混合溶液中由水电离出的c(H+)=____________mol·L-1。
写出该混合溶液中下列精确算式(不能做近似计算)。
c(Cl-)-c(B+)=________________________mol·L-1
c(H+)-c(BOH)=________________________mol·L-1