摘要:25.(1)V=0.0625×22.4=1.4 L ×22.4=0.38 L
网址:http://m.1010jiajiao.com/timu3_id_345577[举报]
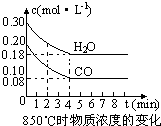 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大
可逆反应的进行程度越大
,K值大小与温度的关系是:温度升高,K值可能增大也可能减小
可能增大也可能减小
.(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=
0.03
0.03
mol?L-1?min-1.t℃时物质浓度(mol?L-1)的变化:(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
平衡
平衡
状态; c 1数值大于
大于
0.08mol?L-1 (填大于、小于或等于).②反应在4min~5min间,平衡向逆方向移动,可能的原因是
d
d
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ?mol-1
其化学平衡常数K和温度T的关系如下表:
请回答:
(1)上述反应中Q
(2)判断该反应已达到化学平衡状态的依据是
a.容器中压强不变 b.反应热△H不变 c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)温度为t℃时,可逆反应CO2(g)+H2(g)?CO(g)+H2O(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
①该反应的反应温度t
②反应在4~5min之间,平衡
a.增加CO的浓度 b.加压 c.使用催化剂 d.增加水蒸气浓度
③t℃时,表中5~6min之间数值发生变化,可能的原因是
a.增加H2O的浓度 b.加压 c.增加氢气浓度 d.使用催化剂.
查看习题详情和答案>>
CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ?mol-1
其化学平衡常数K和温度T的关系如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)上述反应中Q
>
>
0(选填“>”或“<”);(2)判断该反应已达到化学平衡状态的依据是
cd
cd
.a.容器中压强不变 b.反应热△H不变 c.v正(H2)=v逆(CO) d.CO2的质量分数不变
(3)温度为t℃时,可逆反应CO2(g)+H2(g)?CO(g)+H2O(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
| 时间/min | CO2 | H2 | CO | H2O |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
小于
小于
(填“大于”“小于”或“等于”)850℃,判断依据是该温度下的化学平衡常数K=
=
=0.5<1.0,该反应为吸热反应,化学平衡常数随温度的升高而增大
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| (0.100)2 |
| 0.100×0.200 |
该温度下的化学平衡常数K=
=
=0.5<1.0,该反应为吸热反应,化学平衡常数随温度的升高而增大
.| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| (0.100)2 |
| 0.100×0.200 |
②反应在4~5min之间,平衡
向左
向左
(填“向左”“向右”或“不”)移动,可能的原因是d
d
.a.增加CO的浓度 b.加压 c.使用催化剂 d.增加水蒸气浓度
③t℃时,表中5~6min之间数值发生变化,可能的原因是
c
c
.a.增加H2O的浓度 b.加压 c.增加氢气浓度 d.使用催化剂.
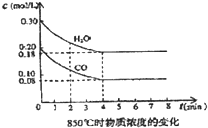 在一体积为10L的容器中,通入一定量的CO和H2O,在85℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-Q kJ/mol CO和H2O浓度变化如图,则
在一体积为10L的容器中,通入一定量的CO和H2O,在85℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-Q kJ/mol CO和H2O浓度变化如图,则(1)0-4min的平均反应速率v(CO)=
0.003
0.003
mol/(L?min)(2)下列能说明反应达到平衡状态的是
ce
ce
.a、每消耗1mol CO2的同时生成l molH2O b、体系压强保持不变
c、v正(CO)=v逆(CO2) d、容器中混合气体的密度保持不变
e、混合气体中H2O的体积分数保持不变 f、CO2和H2的体积比保持不变
t1℃时物质浓度(mol/L)的变化
| 时间 | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min-4min之间反应处于
平衡
平衡
状态;C1数值大于
大于
0.08mol/L(填大于、小于或等于).②反应在4min-5min之间,平衡向逆方向移动,可能的原因是
d
d
(单选),表中5min-6min之间数值发生变化,可能的原因是a
a
(单选).a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
(2008?龙湖区模拟)在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其平衡常数K和温度t的关系如下:
(1)该反应的逆反应为
(2)不能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(3)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2(g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数).
查看习题详情和答案>>
其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
吸热
吸热
反应(“吸热”或“放热”);(2)不能判断该反应是否已经达到化学平衡状态的是:
AD
AD
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(3)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g)其平衡常数K和温度t的关系如下:
(1)K的表达式为:
(2)该反应的正反应为
(3)能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
计算:3min-4min达到平衡时CO的平衡浓度c3=
查看习题详情和答案>>
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
K=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
K=
;| c(CO)c(H2O) |
| c(CO2)c(H2) |
(2)该反应的正反应为
放热
放热
反应(“吸热”或“放热”);(3)能判断该反应是否已经达到化学平衡状态的是:
BC
BC
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
0.12mol/L
0.12mol/L
和CO2(g)的转化率为60%
60%
.