题目内容
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大
可逆反应的进行程度越大
,K值大小与温度的关系是:温度升高,K值可能增大也可能减小
可能增大也可能减小
.(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
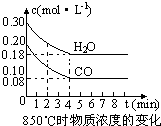
CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=
0.03
0.03
mol?L-1?min-1.t℃时物质浓度(mol?L-1)的变化:(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
平衡
平衡
状态; c 1数值大于
大于
0.08mol?L-1 (填大于、小于或等于).②反应在4min~5min间,平衡向逆方向移动,可能的原因是
d
d
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
分析:(1)依据平衡常数是表示平衡进行程度大小的量;化学反应吸热或放热反应,温度升高平衡向吸热反应方向进行;
(2)根据v=
计算反应速率;
(3)①从表中可看出反应在3min和4min时的各物质浓度相同;温度升高,化学平衡逆向移动;
②根据浓度、压强、温度对平衡移动的影响分析.
(2)根据v=
| △c |
| △t |
(3)①从表中可看出反应在3min和4min时的各物质浓度相同;温度升高,化学平衡逆向移动;
②根据浓度、压强、温度对平衡移动的影响分析.
解答:解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,K越大,说明生成物越多,反应物越少,当反应放热时,升高温度平衡向逆反应方向移动,当反应吸热时,升高温度平衡向正反应方向移动,温度升高,K可能增大,也可能减小,
故答案为:可逆反应进行的程度越大;可能增大也可能减小;
(2)v=
=
=0.03mol/(L?min),故答案为:0.03;
(3)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡.另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L,
故答案为:平衡;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故答案为:d.
故答案为:可逆反应进行的程度越大;可能增大也可能减小;
(2)v=
| △c |
| △t |
| 0.20mol/L-0.08mol/L |
| 4min |
(3)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡.另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L,
故答案为:平衡;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故答案为:d.
点评:本题综合考查化学平衡常数、平衡的有关计算和判断等问题,题目难度较大,将图表信息和图象信息相结合,体现了图象题的新发展.

练习册系列答案
相关题目
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示