网址:http://m.1010jiajiao.com/timu3_id_345567[举报]
传统哈伯法合成氨工艺中相关的反应式为:N2+3H2
| 催化剂 |
| △ |
(1)该反应的平衡常数K的表达式为:K=
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
(2)不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,
| 压强(MPa) 氨的平衡含量(%) 温度(摄氏度) |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |

(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
| ||
| 高温 |
| ||
| 高温 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H②该反应的化学平衡常数表达式为
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
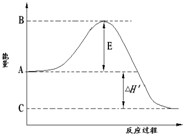 合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:(1)如图是合成氨时的能量变化图,图中A、C分别表示
(增大、减小、不变).当有
| 1 |
| 3 |
(2)下表是按V(N2):V(H2)=1:3合成氨时NH3的百分含量与压强、温度的统计数据:
| 10 | 20 | 30 | 60 | |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 10.6 | 19.1 | 26.4 | 42.0 |
(3)若反应时,反应速率v(N2)为 a mol/L?min,则v(H2)=
(4)在10Pa、400℃时,若以N2(g)与H2(g)的物质的量分别为1mol和3mol进行反应,则达到平衡时,N2(g)的转化率约为
(1)传统哈伯法合成氨工艺中,N2+3H2
| 催化剂 |
| 高温 |
①该反应的平衡常数K的表达式为:K=
| c2(NH3) |
| c(N2)?c3(NH3) |
| c2(NH3) |
| c(N2)?c3(NH3) |
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3 )
| 压强(Mpa) 氨的平衡含(%) 温度(摄氏度) |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
③下列关于合成氨说法正确是
A、使用催化剂可以提高NH3的产率
B、寻找常温下的合适催化剂是未来研究的方向
C、由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2═2N2+6H2O.写出负极电极反应式
项目名称 结果 单位 参考值 ①谷丙转氨酶 7 U/L 40 ②谷草转氨酶 16 U/L 0—40 ③谷酰转肽酶 15 U/L 0—50 ④碱性磷酸酶 77 U/L 34—114 ⑤总胆红素 12.3 μmol·L-1 0—19 ⑥总蛋白 70.6 g·L-1 60—80 ⑦白蛋白 43.9 g·L-1 35—55 ⑧球蛋白 26.7 g·L-1 20—30 ⑨白球比 1.6 1.5—2.5 ⑩乳酸脱氢酶 161 U/L 114—240 ⑾磷酸肌酸激酶 56 U/L 25—200 ⑿甘油三酯 0.52 mmol·L-1 0—1.71 ⒀总胆固醇 4.27 mmol·L-1 3.6—5.18 ⒁高密度脂蛋白胆固醇 1.57 mmol·L-1 1.0—1.6 ⒂低密度脂蛋白胆固醇 1.40 mmol·L-1 0—3.36 ⒃16葡萄糖 4.94 mmol·L-1 3.61—6.11 |
送检日期:2002—09—16 报告日期:2002—09—16 |
其中用物质的量浓度表示的指标有( )
A.①②③④⑩11 B.⑥⑦⑧
C.⑤⑿⒀⒁⒂⒃ D.⑤⑥⑦⑧⑿⒀⒁⒂⒃
查看习题详情和答案>>