摘要:8].在25℃时.将某浓度的芒硝溶液分为等质量的两份溶液.一份加热蒸发掉20g水后降至25℃成为饱和溶液.另一份加入10g芒硝晶体后也成为饱和溶液.则25℃时芒硝的溶解度是 A.20g B.17.23g C.30g D.22.05g
网址:http://m.1010jiajiao.com/timu3_id_345534[举报]
 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
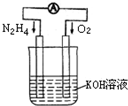
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:
N2H4+O2=N2+2H2O,若将此反应设计成如右图所示的原电池装置,请回答:
①负极反应式为:
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
;②工作一段时间后正极附近溶液的pH变化为
增大
增大
(填“增大”“减小”或“不变”);③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为
0.5 mol?L-1
0.5 mol?L-1
.(2)在25℃时,向浓度均为0.1mol?L-1的MgCl2和CuCl2 混合溶液中逐滴加入氨水,首先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3?H20=Cu(OH)2↓+2NH4+
Cu2++2NH3?H20=Cu(OH)2↓+2NH4+
.(已知25℃Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20).(3)在25℃时,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”“碱”或“中”),用含a的代数式表示NH3?H2O的电离常数kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
已知25℃,氯化银的KSP=1.8×10-10,碘化银的KSP=8.5×10-17.请解答下列问题:
(1)在25℃时,将0.002mol?L-1化钠溶液和0.001mol?L-1硝酸银溶液等体积混合后,混合溶液中 (填“有”、“无”或“无法判断”)氯化银沉淀生成,原因是 .
(2)在25%℃时,将足量氯化银分别放入:①50mL蒸馏水中;②50mL 0.2mol?L-1盐酸中;②50mL 0.2mol?L-1氯化铝溶液中;④50mL 0.2mol?L-1氯化镁溶液中.充分搅拌后,溶液中银离子浓度最小的是 (填序号).在0.2mol?L-1氯化镁溶液中,银子里的浓度最大可达到 mol?L-1.
(3)在含有0.001mol?L-1碘化钠和0.00l mol?L-1氯化钠的混合溶渣中,逐滴加入硝酸银溶液,刚此时首先生成的沉淀是 (填化学式);当氯化银沉淀开始生成时,溶液中I-的物质的量浓度是 .(计算结果保留一位小数)
查看习题详情和答案>>
(1)在25℃时,将0.002mol?L-1化钠溶液和0.001mol?L-1硝酸银溶液等体积混合后,混合溶液中
(2)在25%℃时,将足量氯化银分别放入:①50mL蒸馏水中;②50mL 0.2mol?L-1盐酸中;②50mL 0.2mol?L-1氯化铝溶液中;④50mL 0.2mol?L-1氯化镁溶液中.充分搅拌后,溶液中银离子浓度最小的是
(3)在含有0.001mol?L-1碘化钠和0.00l mol?L-1氯化钠的混合溶渣中,逐滴加入硝酸银溶液,刚此时首先生成的沉淀是
 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题:(1)合成氨反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左
向左
移动(填“向左”、“向右”或“不”),平衡常数K不变
不变
(填“变大”、“变小”或“不变”);使用催化剂不改变
不改变
反应的△H(填“增大”、“减小”或“不改变”).(2)在25℃时,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+
Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+
.(已知25°CKsp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)(3)在25℃时,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”、“碱”或“中”);且a>
>
0.01(填“>”、“=”或“<”).(4)依据反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s) 设计的原电池如图所示:
电极X的材料是
Fe
Fe
;电解质溶液Y是硫酸铜溶液或氯化铜溶液等
硫酸铜溶液或氯化铜溶液等
;若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.
(1)在25℃时,将pH=11 的Ba(OH)2溶液Vb L与 pH=2 的HCl溶液Va L混合,若所得溶液为中性,则Va:Vb= .
(2)在25℃时,已知Ksp[Mg(OH)2]=1.8×10-11,在Mg2+的浓度为0.1mol?L-1的溶液中,调节溶液的酸碱性使 pH=8 (调节过程中溶液体积变化忽略不计).此时有无 Mg(OH)2 沉淀生成 ,(填“有”或“无”) 请通过计算加以说明.
查看习题详情和答案>>
(2)在25℃时,已知Ksp[Mg(OH)2]=1.8×10-11,在Mg2+的浓度为0.1mol?L-1的溶液中,调节溶液的酸碱性使 pH=8 (调节过程中溶液体积变化忽略不计).此时有无 Mg(OH)2 沉淀生成
在25℃时,将0.1mol?L-1的HA溶液与0.1mol?L-1的NaOH溶液等体积混合后,测得混合溶液pH=8,则下列所表示的该混合溶液中有关微粒的浓度关系中,错误的是( )
| A、c(HA)+c(A-)=c(Na+)=0.1mol?L-1 | B、c(Na+)-c(A-)=c(OH-)-c(H+) | C、c(Na+)>c(A-)>c(OH-)>c(H+) | D、c(OH-)=c(H+)+c(HA) |