摘要:(1)过滤除去污泥 (2)滤液中加入过量Fe粉.使Ag+还原为金属银 (3)过滤.将Ag和过量Fe粉从溶液中分离出来 (4)将上述滤渣中加稀H2SO4.使Fe溶解 (5)过滤.分离出银 步滤液合并.蒸发浓缩.冷却.使硫酸亚铁晶体析出 (7)过滤得FeSO4晶体
网址:http://m.1010jiajiao.com/timu3_id_345465[举报]
(2011?闵行区二模)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.
(1)染料工业排放的废水中含有大量有毒的NO2?,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2?离子的离子方程式为
(2)某工厂对制革工业污泥中Cr3+回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
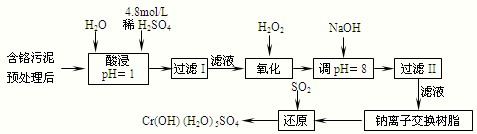
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见表:
①实验室用18.4mol/L的浓硫酸配制250mL 4.8mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需
②酸浸时,为了提高浸取率可采取的措施是
③加入H2O2的作用是
④钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(3)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的试剂(可能用到的试剂:Cl2、浓H2SO4、NaOH溶液、CuO、Cu),简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤①
查看习题详情和答案>>
(1)染料工业排放的废水中含有大量有毒的NO2?,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2?离子的离子方程式为
2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O
2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O
.(2)某工厂对制革工业污泥中Cr3+回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
250mL容量瓶、胶头滴管
250mL容量瓶、胶头滴管
.②酸浸时,为了提高浸取率可采取的措施是
增加浸取时间、不断搅拌混合物、滤渣多次浸取等
增加浸取时间、不断搅拌混合物、滤渣多次浸取等
(答2点).③加入H2O2的作用是
将Fe2+氧化成Fe3+,将Cr3+转变成较高价态的铬,以便于与杂质离子分离
将Fe2+氧化成Fe3+,将Cr3+转变成较高价态的铬,以便于与杂质离子分离
.④钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
Ca2+、Mg2+
Ca2+、Mg2+
(选填:Fe3+、Al3+、Ca2+、Mg2+).(3)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的试剂(可能用到的试剂:Cl2、浓H2SO4、NaOH溶液、CuO、Cu),简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤①
通入足量氯气将Fe2+氧化成Fe3+
通入足量氯气将Fe2+氧化成Fe3+
;②加入CuO调节溶液的pH至[3.2,4.7)
加入CuO调节溶液的pH至[3.2,4.7)
;③过滤.某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥.某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下:
表一废水中各物质的含量
表二 FeSO4和Al2(SO4)3在水中的溶解度
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4?7H2O和Ag.
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③
④
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4?7H2O晶体.
⑤将第
(3)写出步骤③中所有化学反应的离子方程式
(4)在步骤⑤中,加入少量硫酸调节pH的目的是
查看习题详情和答案>>
表一废水中各物质的含量
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是
去除油污
去除油污
.②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③
在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤
在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤
,目的是使Ag+全部还原为金属Ag;④
将③的滤渣溶入足量的稀硫酸,过滤,滤液保留待用
将③的滤渣溶入足量的稀硫酸,过滤,滤液保留待用
,目的是分离出Ag;(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4?7H2O晶体.
⑤将第
③
③
步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后,将溶液加热(温度不超过80℃)蒸发浓缩,冷却结晶
将溶液加热(温度不超过80℃)蒸发浓缩,冷却结晶
,滤出FeSO4?7H2O晶体(3)写出步骤③中所有化学反应的离子方程式
Fe+2Ag+=Fe2++2Ag;Fe2O3+6H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
Fe+2Ag+=Fe2++2Ag;Fe2O3+6H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
.(4)在步骤⑤中,加入少量硫酸调节pH的目的是
抑制Fe2+的水解
抑制Fe2+的水解
.(2013?茂名一模)电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧-钠氧化法”回收Na2Cr2O7等物质.

已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式
(3)滤渣II的主要成分有Zn(OH)2、
(4)“系列操作”中为:继续加入H2SO4,
已知:①除去滤渣II后,溶液中存在如下反应:2C
+2H+=C
+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
(5)工业上还可以在水浸过滤后的溶液Na2CrO4加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式
查看习题详情和答案>>

已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈
碱
碱
性(“酸”、“碱”、“中”)(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式
4
4
Cr(OH)3+4
4
Na2CO3+3O2
3O2
=4
4
Na2CrO4+4
4
CO2+6H2O
6H2O
(3)滤渣II的主要成分有Zn(OH)2、
Al(OH)3
Al(OH)3
(4)“系列操作”中为:继续加入H2SO4,
蒸发浓缩
蒸发浓缩
冷却结晶,过滤.继续加入H2SO4目的是促进平衡CrO42-+2H+?Cr2O72-+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7
促进平衡CrO42-+2H+?Cr2O72-+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7
.已知:①除去滤渣II后,溶液中存在如下反应:2C
| rO | 2- 4 |
| r2O | 2- 7 |
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 化学式 |
20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
CrO42-+8H++6e-=Cr+4H2O
CrO42-+8H++6e-=Cr+4H2O
.
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理.
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为 .
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是 (至少写一条).
(2)调pH=8是为了除去 (填Fe3+、Al3+、Ca2+、Mg2+).
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是 (填Fe3+、Al3+、Ca2+、Mg2+).
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O=□Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为 .
(三)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
① ;
② ;
③过滤.(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu). 查看习题详情和答案>>
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH |
1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH |
3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)调pH=8是为了除去
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O=□Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为
(三)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
①
②
③过滤.(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu). 查看习题详情和答案>>
某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是 。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③ ,目的是使Ag+全部还原为金属Ag;
④ ,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第 步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后, ,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式 。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是 。 查看习题详情和答案>>