题目内容
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理.(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体).除去NO2-的离子方程式为
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH |
1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH |
3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)调pH=8是为了除去
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O=□Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为
(三)印刷电路铜板腐蚀剂常用FeCl3.腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
①
②
③过滤.(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu).
分析:(一)加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体,说明产物之一为一水合氨,Al作还原剂,失去电子后在碱性条件下生成偏铝酸根离子,NO2-作氧化剂,依据电荷守恒和原子守恒写出离子方程式;
(二)(1)为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度两个角度分析;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(3)钠离子交换树脂交换的离子是钙离子和镁离子;
(4)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写,根据方程式计算;
(三)除去CuCl2溶液中Fe3+和Fe2+的实验步骤是:通入足量的氯气将Fe2+氧化为Fe3+;加入CuO调节溶液PH值3.2-4.7使铁离子沉淀完全,然后过滤.
(二)(1)为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度两个角度分析;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;
(3)钠离子交换树脂交换的离子是钙离子和镁离子;
(4)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写,根据方程式计算;
(三)除去CuCl2溶液中Fe3+和Fe2+的实验步骤是:通入足量的氯气将Fe2+氧化为Fe3+;加入CuO调节溶液PH值3.2-4.7使铁离子沉淀完全,然后过滤.
解答:解:(一)加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体,说明产物之一为一水合氨,Al作还原剂,失去电子后在碱性条件下生成偏铝酸根离子,NO2-作氧化剂,依据电荷守恒和原子守恒配平得离子方程式:2Al+OH-+NO2-+2H2O═2AlO2-+NH3?H2O,
故答案为:2Al+OH-+NO2-+2H2O═2AlO2-+NH3?H2O;
(二)(1)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:增加浸取时间、不断搅拌混合物、滤渣多次浸取等;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:Fe3+、Al3+;
(3)钠离子交换树脂交换的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
(4)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平;2Na2CrO4+3SO2+12H2O=2CrOH(H2O)5SO4↓+Na2SO4,
根据方程式:3SO2~2CrOH(H2O)5SO4
x 1mol
所以x=1.5mol
故答案为:2;3;12;2;1;1.5mol;
(三)根据上表给出的数据和提供的药品,除去CuCl2溶液中Fe3+和Fe2+的实验步骤是:通入足量的氯气将Fe2+氧化为Fe3+、加入CuO调节溶液PH值3.2-4.7使铁离子沉淀完全,然后过滤,
故答案为:①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7.
故答案为:2Al+OH-+NO2-+2H2O═2AlO2-+NH3?H2O;
(二)(1)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:增加浸取时间、不断搅拌混合物、滤渣多次浸取等;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:Fe3+、Al3+;
(3)钠离子交换树脂交换的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
(4)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平;2Na2CrO4+3SO2+12H2O=2CrOH(H2O)5SO4↓+Na2SO4,
根据方程式:3SO2~2CrOH(H2O)5SO4
x 1mol
所以x=1.5mol
故答案为:2;3;12;2;1;1.5mol;
(三)根据上表给出的数据和提供的药品,除去CuCl2溶液中Fe3+和Fe2+的实验步骤是:通入足量的氯气将Fe2+氧化为Fe3+、加入CuO调节溶液PH值3.2-4.7使铁离子沉淀完全,然后过滤,
故答案为:①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7.
点评:本题考查了离子方程式、化学方程式的书写、物质的分离等知识点,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是除去杂质且不引进新的杂质,本题难度较大.

练习册系列答案
相关题目
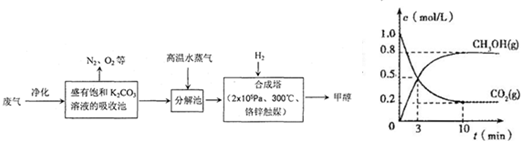
(16分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:
合成塔中反应的化学方程式为 ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考 虑温度对反应速率的影响外,还主要考虑了 。
虑温度对反应速率的影响外,还主要考虑了 。
从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)。
| A.过滤 | B.分液 | C.蒸馏 | D.结晶 |
(4)在体积为2L的合成塔中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2) =______________;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有 。

(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知CH4(g)+2O2(g)=" CO2(g)+2H2O(l)" ΔH1=-890.3kJ/mol
H2 (g)+ O2(g)=" H2O(l)" ΔH2=-285.8kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________。








 增大
增大 
