摘要:D,A,
网址:http://m.1010jiajiao.com/timu3_id_345178[举报]
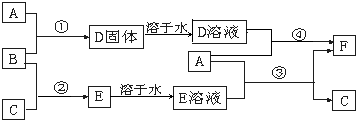
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
请回答:
(1)写出B物质的化学式:
(2)写出第③步反应的化学方程式为
(3)第④步反应中溶液颜色的变化
(4)写出SO2和B反应的离子方程式
(5)F溶液中滴入NaOH溶液可能产生的实验现象是
查看习题详情和答案>>

请回答:
(1)写出B物质的化学式:
Cl2
Cl2
;F的名称:氯化亚铁
氯化亚铁
.(2)写出第③步反应的化学方程式为
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
.(3)第④步反应中溶液颜色的变化
溶液由黄色变为浅绿色
溶液由黄色变为浅绿色
;写出第④步反应的离子方程式2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(4)写出SO2和B反应的离子方程式
SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Cl2+2H2O=4H++SO42-+2Cl-
.(5)F溶液中滴入NaOH溶液可能产生的实验现象是
先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
.A与B在一定条件下反应生成C,进一步反应生成抗氧化剂“安维那”D.其分子式为C10H10O4.A对氢气的相对密度为52,1molA与足量的NaHCO3反应生成2mol气体.B属于芳香族化合物.已知: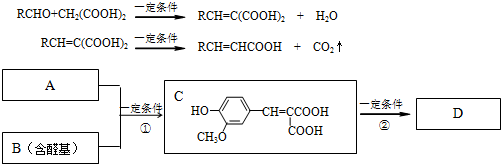
(1)C可能发生的反应是:
a.氧化反应 b.水解反应 c.消去反应 d.酯化反应
(2)等物质的量的C分别与足量的Na、NaHCO3、NaOH反应时消耗Na、NaHCO3、NaOH的物质的量之比是
(3)A的分子式为
(4)反应①的方程式是
 .
.
(5)符合下列条件的D的同分异构体有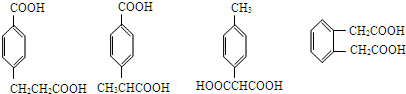 任意一种
任意一种 任意一种.
任意一种.
①在苯环上只有两个取代基; ②苯环上的一氯取代物只有两种; ③1mol该同分异构体与足量NaHCO3反应生成2molCO2.
查看习题详情和答案>>

(1)C可能发生的反应是:
ad
ad
(填序号).a.氧化反应 b.水解反应 c.消去反应 d.酯化反应
(2)等物质的量的C分别与足量的Na、NaHCO3、NaOH反应时消耗Na、NaHCO3、NaOH的物质的量之比是
3:2:3
3:2:3
.(3)A的分子式为
C3H4O4
C3H4O4
.(4)反应①的方程式是


(5)符合下列条件的D的同分异构体有
4
4
种,写出其中任意一种的结构简式; 任意一种
任意一种 任意一种
任意一种①在苯环上只有两个取代基; ②苯环上的一氯取代物只有两种; ③1mol该同分异构体与足量NaHCO3反应生成2molCO2.
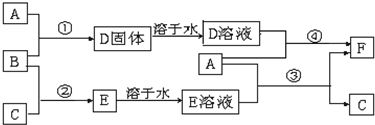
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
请回答:
(1)写出B物质的化学式:
(2)写出第③步反应的化学方程式为
(3)第④步反应中溶液颜色的变化
(4)F溶液中滴入NaOH溶液可能产生的实验现象是
查看习题详情和答案>>

请回答:
(1)写出B物质的化学式:
Cl2
Cl2
;F的名称:氯化亚铁
氯化亚铁
.(2)写出第③步反应的化学方程式为
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
.(3)第④步反应中溶液颜色的变化
溶液由黄色变为浅绿色
溶液由黄色变为浅绿色
;(4)F溶液中滴入NaOH溶液可能产生的实验现象是
先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
.A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液.
先打开止水夹,通入N2,待装置中空气被赶尽后关闭止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置无O3).
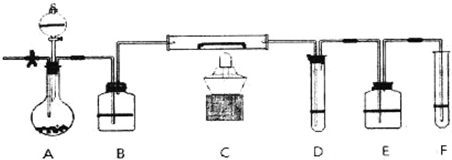
(1)淡黄色固体所含化学键的名称为:
(2)如何检查装置的气密性
(3)C中反应的化学方程式
(4)E装置中反应的离子方程式
(5)如F中仍有Fe2+,如何检验含有Fe2+
查看习题详情和答案>>
先打开止水夹,通入N2,待装置中空气被赶尽后关闭止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置无O3).

(1)淡黄色固体所含化学键的名称为:
离子键、共价键
离子键、共价键
;装有遮黄色的固体仪器的名称圆底烧瓶
圆底烧瓶
.(2)如何检查装置的气密性
关闭止水夹,将F中的导管伸入水槽中,用酒精灯给圆底烧瓶微热,导管口有气泡产生,冷却后,导管出现水柱
关闭止水夹,将F中的导管伸入水槽中,用酒精灯给圆底烧瓶微热,导管口有气泡产生,冷却后,导管出现水柱
.(3)C中反应的化学方程式
4HCl+O2
2Cl2+2H2O
| ||
| △ |
4HCl+O2
2Cl2+2H2O
.
| ||
| △ |
(4)E装置中反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(5)如F中仍有Fe2+,如何检验含有Fe2+
取F中少量溶液于小试管中,滴加一滴高锰酸钾溶液,高锰酸钾溶液褪色,说明含有Fe2+
取F中少量溶液于小试管中,滴加一滴高锰酸钾溶液,高锰酸钾溶液褪色,说明含有Fe2+
.A-J是中学化学中常见的物质,它们之间的转化关系如框图1所示(部分产物已略去).已知A是一种高熔点物质,J是一种红褐色沉淀.请回答下列问题:
(1)A的化学式为
(2)H溶液中通入过量的CO2,其反应的离子方程式是
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
(4)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
①图2中oc段没有沉淀生成,此阶段发生反应的离子方程式为
②在de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
上述现象说明溶液中
③b与a的差值为
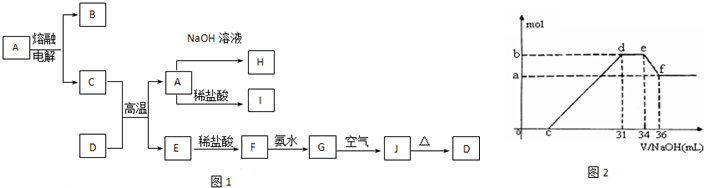
查看习题详情和答案>>
(1)A的化学式为
Al2O3
Al2O3
(2)H溶液中通入过量的CO2,其反应的离子方程式是
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
G→J的化学方程式为4Fe(OH)2+2H2O+O2═4Fe(OH)3
4Fe(OH)2+2H2O+O2═4Fe(OH)3
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(4)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
①图2中oc段没有沉淀生成,此阶段发生反应的离子方程式为
H++OH-=H2O
H++OH-=H2O
.②在de段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
;上述现象说明溶液中
H+
H+
结合OHˉ的能力最强(填离子符号).③b与a的差值为
0.008mol
0.008mol
mol.