摘要:(1)MnO2+4HCl(浓) =MnCl2+Cl2↑+2H2O 向上排空气法,浓H2SO4 (2)①稀盐酸.大理石颗粒.铜网.穿有铜丝的双孔软木塞, ②将稀盐酸置于分液漏斗中.大理石颗粒置于铜网内.铜网与铜丝连结. ③将铜网从盐酸溶液中提出.使大理石与盐酸分离.使反应停止.
网址:http://m.1010jiajiao.com/timu3_id_345177[举报]
已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子.反应中部分生成物已略去.
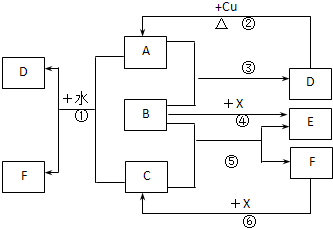
试回答下列问题:
(1)根据图中信息,物质B、C、X氧化性从强到弱的顺序是
(2)B的电子式为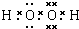
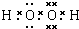 ,它属于
,它属于
(3)写出反应②的化学方程式:
(4)写出反应①、⑥的离子方程式:
①
⑥
查看习题详情和答案>>

试回答下列问题:
(1)根据图中信息,物质B、C、X氧化性从强到弱的顺序是
MnO2>Cl2>H2O2
MnO2>Cl2>H2O2
.(用化学式表示)(2)B的电子式为
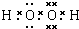
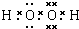
分子
分子
晶体.(3)写出反应②的化学方程式:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(4)写出反应①、⑥的离子方程式:
①
Cl2+SO2+2H2O═4H++SO22-+2Cl-
Cl2+SO2+2H2O═4H++SO22-+2Cl-
.⑥
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
下列两个反应均为在溶液中进行的反应,试按下列要求作答:
①用双线桥标明下列反应中电子的转移及数目;
②在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物.
③将其改写成离子方程式;
(1)2FeCl3+H2S═2FeCl2+S↓+2HCl
离子方程式为:
(2)MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
离子方程式为:
查看习题详情和答案>>
①用双线桥标明下列反应中电子的转移及数目;
②在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物.
③将其改写成离子方程式;
(1)2FeCl3+H2S═2FeCl2+S↓+2HCl
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
2Fe3++H2S=2Fe2++S↓+2H+
2Fe3++H2S=2Fe2++S↓+2H+
.(2)MnO2+4HCl(浓)
| ||
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(A)针对以下A~D四个涉及H2O2的反应(未配平),填写空白:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2→H2O+O2
D. H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号)
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)
(3)H2O2体现弱酸性的反应是(填代号)
(B)某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为
(2)装置A的烧瓶中可装试剂
(3)B装置的名称是
(4)通入C装置的两根导管左边较长、右边较短,目的是
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
查看习题详情和答案>>
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2+H2O
C.H2O2→H2O+O2
D. H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号)
D
D
,该反应配平的化学方程式为3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
.(2)H2O2既体现氧化性又体现还原性的反应是(填代号)
C
C
.(3)H2O2体现弱酸性的反应是(填代号)
A
A
,其理由为这一反应可看作是强酸制取弱酸的反应
这一反应可看作是强酸制取弱酸的反应
.(B)某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)装置A的烧瓶中可装试剂
生石灰或固体氢氧化钠
生石灰或固体氢氧化钠
.(3)B装置的名称是
球形干燥管
球形干燥管
;E装置的作用除去氯气中的HCl
除去氯气中的HCl
.(4)通入C装置的两根导管左边较长、右边较短,目的是
使密度大的氯气与密度小的氨气较快地均匀混合
使密度大的氯气与密度小的氨气较快地均匀混合
.(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:
3Cl2+8NH3═N2+6NH4Cl
3Cl2+8NH3═N2+6NH4Cl
.元素X、Y、Z、W均为短周期元素,且原子序数依次增大.已知Y原子最外层电子数占核外电子总数的
,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素.据此回答下列问题:
(1)W在元素周期表中的位置
(2)A、B均由上述四种元素中的三种组成的强电解质,A是一种强碱,B是某种家用消毒液的有效成分,则A、B的化学式分别为
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1:1,则C的电子式是
 .
.
查看习题详情和答案>>
| 3 |
| 4 |
(1)W在元素周期表中的位置
第三周期ⅦA族
第三周期ⅦA族
,实验室制取W单质的离子方程式是MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑
| ||
MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑
;
| ||
(2)A、B均由上述四种元素中的三种组成的强电解质,A是一种强碱,B是某种家用消毒液的有效成分,则A、B的化学式分别为
NaOH
NaOH
、NaClO
NaClO
;(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1:1,则C的电子式是

