网址:http://m.1010jiajiao.com/timu3_id_345071[举报]
研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题:

(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
(填写序号)
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+ (aq)+4e-
(aq)+4e- PbSO4(s)+2H2O(1)
PbSO4(s)+2H2O(1)
D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准
状况下)
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-,请回答下列问题:
H++A2-,请回答下列问题:
①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);
△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);
△H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g) 2SO3(g)。在一定温度下,将0.23 mol
SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50
mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol
SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50
mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
查看习题详情和答案>>
研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题:
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
(填写序号)
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+(aq)+4e-
PbSO4(s)+2H2O(1)
D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准
状况下)
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA-H++A2-,请回答下列问题:
①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)CH3OH(g); △H=-90.8kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g);△=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g)2SO3(g)。在一定温度下,将0.23 molSO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
查看习题详情和答案>>
研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题: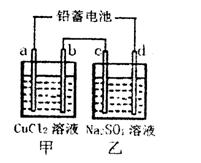
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______ ______
______
(填写序号)
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 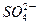 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA-
 H++A2-,请回答下列问题:
H++A2-,请回答下列问题:①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1
 mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1②2
 CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g)
 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
查看习题详情和答案>>
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
查看习题详情和答案>>
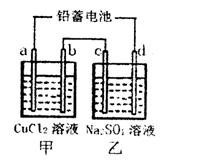
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)
 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______ ______
______(填写序号)
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 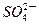 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA-
 H++A2-,请回答下列问题:
H++A2-,请回答下列问题:①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1
 mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1②2
 CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g)
 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+1/2O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ/mol
请回答下列问题:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:____________________.
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比 1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出如下列循环图:
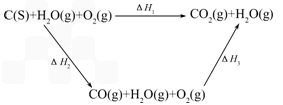
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点: ____________________、____________________.
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料.CO和H2在一定条件下可以合成: ①甲醇(CH4O) ②甲醛(CH2O) ③甲酸(CH2O2) ④乙酸(C2H4O2).试分析当CO和H2按1:1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.