摘要: 将3 摩A 和2.5 摩B 充入容积为2升的密闭容器中.发生如下反应: 3A + 2D(气).5分钟时反应达平衡状态.生成1摩D , 经测定.以C表示的平均反应速度为0.1摩/. 下列结论中错误的是( ) ① 平衡时B 的转化率为20% ② 平衡时B 的浓度为1摩/升 ③ 经计算.n值为1 ④ 用A 表示的平衡反应速度为0.3摩/ ①.④ ③.④
网址:http://m.1010jiajiao.com/timu3_id_34461[举报]
将3 摩A 和2.5 摩B 充入容积为2升的密闭容器中,发生如下反应:3A(气)+B(气) nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
①平衡时B 的转化率为20% ②平衡时B 的浓度为1摩/升③经计算,n值为1 ④用A 表示的平衡反应速度为0.3摩/(升?分)( )
 nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是①平衡时B 的转化率为20% ②平衡时B 的浓度为1摩/升③经计算,n值为1 ④用A 表示的平衡反应速度为0.3摩/(升?分)( )
查看习题详情和答案>>
将3 摩A 和2.5 摩B 充入容积为2升的密闭容器中,发生如下反应:3A(气)+B(气)

nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
①平衡时B 的转化率为20% ②平衡时B 的浓度为1摩/升③经计算,n值为1 ④用A 表示的平衡反应速度为0.3摩/(升?分)( )
查看习题详情和答案>>

nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
①平衡时B 的转化率为20% ②平衡时B 的浓度为1摩/升③经计算,n值为1 ④用A 表示的平衡反应速度为0.3摩/(升?分)( )
| A.①、② | B.①、④ | C.②、③ | D.③、④ |
将3 摩A 和2.5 摩B 充入容积为2升的密闭容器中,发生如下反应:3A(气)+B(气) nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/,下列结论中错误的是
nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/,下列结论中错误的是
①平衡时B 的转化率为20% ②平衡时B 的浓度为1摩/升③经计算,n值为1 ④用A 表示的平衡反应速度为0.3摩/( )
A.①、②
B.①、④
C.②、③
D.③、④
查看习题详情和答案>>
 nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/,下列结论中错误的是
nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D; 经测定,以C表示的平均反应速度为0.1摩/,下列结论中错误的是①平衡时B 的转化率为20% ②平衡时B 的浓度为1摩/升③经计算,n值为1 ④用A 表示的平衡反应速度为0.3摩/( )
A.①、②
B.①、④
C.②、③
D.③、④
查看习题详情和答案>>
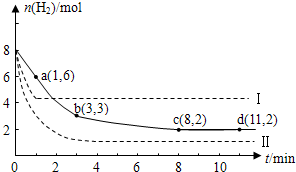 (2011?闵行区二模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
(2011?闵行区二模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标):
回答下列问题:
(1)图中a点时,正反应速率
大于
大于
(填“大于”、“等于”或“小于”)逆反应速率.(2)由图分析,在下列时间段内反应速率最快的时间段是
a
a
(填答案编号).a.0~1min b.1~3min c.3~8min d.8~11min
(3)该反应在0~8min内CO2的平均反应速率是
0.125
0.125
mol/(L?min).(4)该反应的平衡常数表达式为:K=
| [CH3OH]?[H2O] |
| [CO2]?[H2]3 |
| [CH3OH]?[H2O] |
| [CO2]?[H2]3 |
(5)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,曲线Ⅰ改变的条件可能是
升高温度
升高温度
,曲线Ⅱ改变的条件可能是增大压强
增大压强
.若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
K1<K2=K
K1<K2=K
.(6)下列表述能表示该反应已达平衡的是
a、c
a、c
(填答案编号).a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等.