网址:http://m.1010jiajiao.com/timu3_id_344166[举报]
为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如图所示的实验装置:

①其中:
 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.②酸性KMnO4溶液体积为200mL,浓度为0.1mol?L-1.回答下列问题:
(1)配制200mL0.1mol?L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有
(2)写出并配平测定SO2含量的离子方程式:
(3)若气体流速管中气体流速为acm3/min,当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为
| 3.2 |
| at |
| 3.2 |
| at |
(4)实验中棉花的作用是
若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):
(16分)配 制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
Ⅰ、请将下述实验步骤中缺少的文字请补充完整
(1)实验中选用的仪器除托盘天平、砝码、镊子、量筒、玻璃棒外还必须用到
仪器。
(2)计算:所需NaOH的质量为 g;
(3)称量:用托盘天平称量时,首先将托盘天平调平,将 放在天平的左盘上称量其质量,再添上 g砝码后,向左盘加NaOH固体到平衡为止;
(4)溶解:向盛有NaOH的烧杯中加入70mL水并用玻璃棒 使其溶解;
(5)转移:将步骤(4)中溶液用玻璃棒 注入容量瓶中,在烧杯中加入少量的水,小心洗涤2—3次后并将洗涤液移入容量瓶中 ;
(6)定容:继续往容量瓶中加水至液面接近刻度线 cm处,改用 加水至刻度线,注意视线与 保持水平,加盖摇匀。
(7)贮存: 将溶液倒入试剂瓶中保存,贴上标签注明溶液的浓度和配制日期。
(10分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂志,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2已过量的方法是 。
(2)第④步中,相关的例子方程式 。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
(4)为检验精盐纯度,需配制200ml0.1mol/LnaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是 。
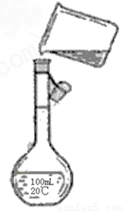
查看习题详情和答案>>
(10分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂志,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是 。
(2)第④步中,相关的例子方程式 。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
(4)为检验精盐纯度,需配制200ml0.1mol/LnaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是 。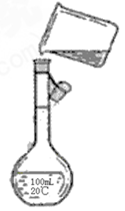
5SO2+2
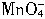 +2H2O=2Mn2++5
+2H2O=2Mn2++5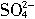 +4H+
+4H+现有药品:0.1mol?L-1的酸性KMnO4溶液、品红溶液、pH试纸。
(1)配制200mL0.1mol?L-1的酸性KMnO4溶液,常用的仪器有玻璃棒、______、______、______、_______等。玻璃棒的作用是__________、____________。
(2)若要测定空气中SO2的含量,需要测出的数据有_________。空气中SO2的含量为_________。
(3)某火力发电厂所在地有较丰富的碳酸钙矿和菱镁矿,若该发电厂以含硫重油为燃料,请你就地取材提出三种除去产生的二氧化硫的方法(用化学方程式表示):①_________;②_________;③__________。 查看习题详情和答案>>