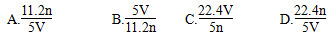摘要:15.工业上将硫磺混入Na2SO3溶液中共热至沸可制取Na2S2O3, .制备Na2S2O3的另一种方法是把SO2通入Na2S和Na2CO3的混合溶液中.在反应过程中.先生成浅黄色沉淀.其量逐渐增多.然后又逐渐减少.当形成无色透明溶液时.反应完成. (1)写出用上述反应制备Na2S2O3的化学方程式① ,② ,③ ,④ (2)原料中Na2CO3.Na2S和SO2的物质的量之比最好的是 . (3)若SO2过量.则又会有黄色沉淀出现.其原因是 .
网址:http://m.1010jiajiao.com/timu3_id_344006[举报]
工业上将氨气和空气的混合气体通过铂一铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应.并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
(2011?朝阳区二模)已知甲、乙、丙均为常见气体,其中甲在空气中含量最多,乙在相同条件下密度最小,丙有刺激性气味,且一个丙分子由四个原子构成.
(1)实验室中可用下图A或B装置与相应的药品制得丙.
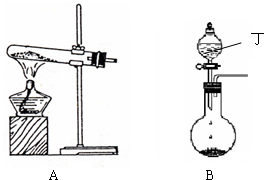
①A中试管内反应的化学方程式是
②B中分液漏斗内盛放的物质丁是
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
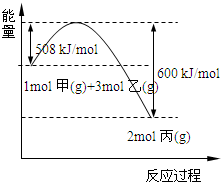
该反应的热化学方程式是
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
(5)若用(1)中得A制取丙,并用园底烧瓶通过排气法收集丙(标准状况),然后进行喷泉实验.当水进入到烧瓶体积得3/5时,液面不再上升,此时立即关闭止水夹,烧瓶内溶液中溶质的物质的量浓度是
查看习题详情和答案>>
(1)实验室中可用下图A或B装置与相应的药品制得丙.

①A中试管内反应的化学方程式是
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
②B中分液漏斗内盛放的物质丁是
浓氨水
浓氨水
,圆底烧瓶内的物质是氧化钙(氢氧化钠或碱石灰)
氧化钙(氢氧化钠或碱石灰)
.(均填名称)(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:

该反应的热化学方程式是
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
.(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
4NH3+3O2
2N2+6H2O
| ||
4NH3+3O2
2N2+6H2O
.
| ||
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
NH3+CO2+H2O+Na+=NaHCO3↓+NH4+
NH3+CO2+H2O+Na+=NaHCO3↓+NH4+
.②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
0.0045
0.0045
mol/L(精确到0.001).