摘要:1mol/L由第3周期某元素形成的某 酸溶液25mL.加入酸溶液的体积V和 安培计的读数的坐标图如图(b) (1)此酸的化学式为 , (2)处于C点时.溶液中导电的阳离子主要是 , (3)处于F点时.溶液中导电的阴离子主要是 , (4)烧杯中刚加入酸时.观察到的现象是 , 中.从A→E电流强度I变小的主要原因是 .
网址:http://m.1010jiajiao.com/timu3_id_343862[举报]
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,E是大气污染物且为红棕色气体,F是一元强酸,反应①是工业制备F的第一步反应.A、B含同一种元素.(某些产物可能略去)
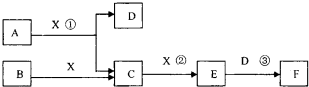
请回答下列问题:
(l)B的电子式为______.写出A与X反应的化学方程式______.
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是______(填序号)
①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式______
(4)在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v1和v2的关系为V1______V2(选填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序可能是______(写出一种情况即可).
查看习题详情和答案>>
有一实验如图所示:
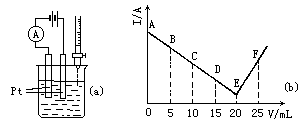
将30 mL 0.1mol/L 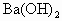 溶液置于烧杯中,然后边搅拌边慢慢加入0.1 mol/L由某第三周期元素形成的某酸溶液25 mL.加入酸溶液的体积V和安培计读数的坐标如上图所示.
溶液置于烧杯中,然后边搅拌边慢慢加入0.1 mol/L由某第三周期元素形成的某酸溶液25 mL.加入酸溶液的体积V和安培计读数的坐标如上图所示.
(1)此酸的化学式为_______.
(2)处于C点时,溶液中导电的阳离子主要是________.
(3)处于F点时,溶液中导电的阴离子主要是________.
(4)烧杯中刚加入酸时,观察到的现象是_______.
(5)图b中,从A→E电流强度I变小的主要原因是________.
查看习题详情和答案>> 某溶液的导电性实验装置如图a所示,将30mL0.1mol?L-1
Ba(OH)2溶液置于烧杯中,然后边搅拌边慢慢加入0.1mol?L-1由第3周期某元素形成的某酸溶液25mL。加入酸溶液的体积(V)和安培计读数(I)的关系如图b所示。
试回答下列问题:
(1)此酸的化学式为______________________。
(2)处于C点时,溶液中导电的阳离子主要是____。
(3)烧杯中刚加入酸时,观察到的现象是________
__________。
(4)图b中,从A→E电流强度 I 变小的主要原因是_____________________________________________。

已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,E是大气污染物且为红棕色气体,F是一元强酸,反应①是工业制备F的第一步反应.A、B含同一种元素.(某些产物可能略去)
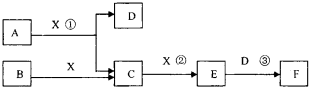
请回答下列问题:
(l)B的电子式为______.写出A与X反应的化学方程式______.
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是______(填序号)
①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式______
(4)在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v1和v2的关系为V1______V2(选填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序可能是______(写出一种情况即可).
查看习题详情和答案>>

请回答下列问题:
(l)B的电子式为______.写出A与X反应的化学方程式______.
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是______(填序号)
①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式______
(4)在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v1和v2的关系为V1______V2(选填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序可能是______(写出一种情况即可).
(2013?红桥区二模)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,E是大气污染物且为红棕色气体,F是一元强酸,反应①是工业制备F的第一步反应.A、B含同一种元素.(某些产物可能略去)
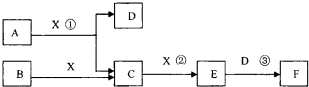
请回答下列问题:
(l)B的电子式为
 .写出A与X反应的化学方程式
.写出A与X反应的化学方程式
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是
①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式
(4)在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v1和v2的关系为V1
查看习题详情和答案>>

请回答下列问题:
(l)B的电子式为


4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是
①③④
①③④
(填序号)①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
(4)在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v1和v2的关系为V1
<
<
V2(选填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序可能是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(写出一种情况即可).