摘要:3. 如图.有一容积为300mL的注射器.与蒸馏烧瓶相连.烧瓶中有0.384gCu片.现向烧瓶中加入18mL2.5mol/L的稀硝酸溶液.并立即用锡箔包住的橡皮塞封住瓶口. ⑴欲提高Cu和稀HNO3的反应速率.可采取多种不同的措施: ①若采用加入化学试剂的方法.可加入 A.水 B.无水醋酸钠 C.铂丝 D.硝酸锌 ②若用升高温度的方法.还需用到的仪器有 ⑵橡皮塞用锡箔包住的原因是 ⑶反应开始后.烧瓶中可观察到的现象主要有① ② ③ . ⑷停止反应后.轻轻推拉注射器活塞.使气体与气体.气体与液体皆充分反应.若忽略液体体积的变化.最终溶液中NO3-的物质的量浓度与开始时相比 A.不变 B.变大 C.变小 D.无法确定
网址:http://m.1010jiajiao.com/timu3_id_342871[举报]
如图(尚有部分仪器未画),有一蒸馏烧瓶与注射器相连接,向蒸馏烧瓶中先加入0.384g铜片和18mL、2.5mol/L的稀硝酸溶液,立即用锡箔包住的橡胶塞封住烧瓶瓶口,实验装置内的空气在标准状况下为500mL(其中注射器内不少于其体积1/2,见图示).

(1)欲提高Cu与HNO3反应的速率可采用多种不同措施.
①若采用加化学试剂法,可加入的试剂为________;
A.蒸馏水
B.无水醋酸钠
C.块状石墨
②若用升高温度法,请在上述示意图空缺处画出必需的仪器.
(2)当烧瓶中的Cu和HNO3反应开始后,可观察到的现象有________.
(3)待Cu与HNO3反应停止后,通过轻轻推拉注射器活塞,使装置内气体与气体、气体与液体之间充分反应,若忽略液体体积变化,最终溶液中NO3-的物质的量浓度与开始时相比是否有变化________(填“有变化”或“不变”).
(4)在上述反应过程中,曾经被还原的硝酸为________mol.
查看习题详情和答案>>某学习小组按如图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出).
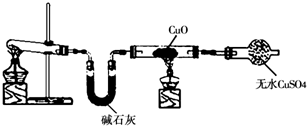
请回答:
(1)制取氨气的化学方程式是
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
①实验Ⅰ、Ⅱ、Ⅲ的目的是
②实验Ⅳ中反应的本质是(用离子方程式表示)
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是
查看习题详情和答案>>

请回答:
(1)制取氨气的化学方程式是
Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑
| ||
Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑
.
| ||
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
3CuO+2NH3
3Cu+N2+3H2O
| ||
3CuO+2NH3
3Cu+N2+3H2O
.②碱石灰的作用是
| ||
吸收氨气中混有的水蒸气,防止干扰产物的鉴定
吸收氨气中混有的水蒸气,防止干扰产物的鉴定
.(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解
说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解
.②实验Ⅳ中反应的本质是(用离子方程式表示)
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
.③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是
Cu+2H++H2O2=Cu2++2H2O
Cu+2H++H2O2=Cu2++2H2O
.某学习小组按如图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出).
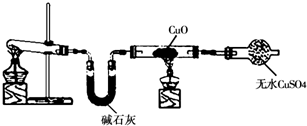
请回答:
(1)制取氨气的化学方程式是______.
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式______.②碱石灰的作用是______.
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
②实验Ⅳ中反应的本质是(用离子方程式表示)______.
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是______. 查看习题详情和答案>>
某学习小组按如图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出).
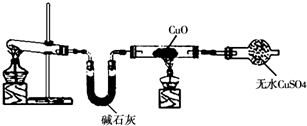
请回答:
(1)制取氨气的化学方程式是______.
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式______.②碱石灰的作用是______.
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
①实验Ⅰ、Ⅱ、Ⅲ的目的是______.
②实验Ⅳ中反应的本质是(用离子方程式表示)______.
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是______.
查看习题详情和答案>>

请回答:
(1)制取氨气的化学方程式是______.
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式______.②碱石灰的作用是______.
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
②实验Ⅳ中反应的本质是(用离子方程式表示)______.
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是______.
(2008?德阳模拟)为测定Na2CO3与Na2SO3混合物中各组分的含量,某同学设计了如下图所示的装置进行实验(铁架台、铁夹等仪器未在图中画出).请回答下列问题:
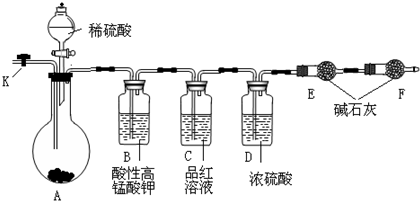
(1)将仪器连接好以后,必须进行的第一步操作是
(2)装置C的作用是
(3)实验过程中,当装置A内的固体反应完全后,需打开活塞K,向A中通入大量的空气.这样做的目的是
(4)有人经过分析推测,用该套装置进行实验,可能会引起Na2CO3含量的测定值比实际值偏低,你认为他的理由是
查看习题详情和答案>>

(1)将仪器连接好以后,必须进行的第一步操作是
检验装置的气密性
检验装置的气密性
.(2)装置C的作用是
检验SO2是否除尽
检验SO2是否除尽
.装置F的作用是防止空气中的CO2和水蒸气进入E中
防止空气中的CO2和水蒸气进入E中
.(3)实验过程中,当装置A内的固体反应完全后,需打开活塞K,向A中通入大量的空气.这样做的目的是
使生成的二氧化碳能够全部装置E中药品吸收
使生成的二氧化碳能够全部装置E中药品吸收
.所通空气应先经过装有碱石灰
碱石灰
(填试剂名称)的装置处理,否则可能引起Na2SO3含量的测定值比实际值偏低
偏低
(填“偏高”、“偏低”或“没影响”).(4)有人经过分析推测,用该套装置进行实验,可能会引起Na2CO3含量的测定值比实际值偏低,你认为他的理由是
CO2可能有部分溶于B、C、D的水中
CO2可能有部分溶于B、C、D的水中
.