摘要:14.向体积均为1L.pH均等于2的盐酸和醋酸中.分别投入0.28gFe.则下图中的曲线符合事实的是
网址:http://m.1010jiajiao.com/timu3_id_341780[举报]
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
 )>c(
)>c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
)B.c(
 )+c(
)+c( )=c(
)=c( )+2c(
)+2c( )+c(
)+c( )
)C.c(
 )+c(
)+c( )=c(
)=c( )+c(
)+c( )
)D.两溶液中c(
 )、c(
)、c( )、c(
)、c( )分别相等
查看习题详情和答案>>
)分别相等
查看习题详情和答案>>
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,t℃___________25℃(填“大于”、“小于”或“等于”),该温度下水的离子积常数Kw = ___________。
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(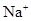 )>c(
)>c(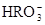 )>c(
)>c(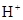 )>c(
)>c(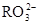 )>c(
)>c(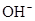 )
)
B.c(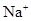 )+c(
)+c(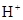 )=c(
)=c(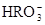 )+2c(
)+2c(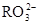 )+c(
)+c(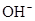 )
)
C.c(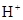 )+c(
)+c(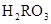 )=c(
)=c(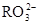 )+c(
)+c(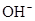 )
)
D.两溶液中c(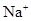 )、c(
)、c(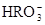 )、c(
)、c(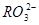 )分别相等
)分别相等
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
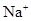 )>c(
)>c(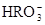 )>c(
)>c(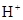 )>c(
)>c(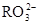 )>c(
)>c(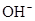 )
)B.c(
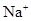 )+c(
)+c(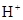 )=c(
)=c(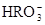 )+2c(
)+2c(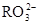 )+c(
)+c(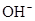 )
)C.c(
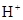 )+c(
)+c(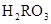 )=c(
)=c(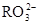 )+c(
)+c(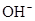 )
)D.两溶液中c(
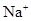 )、c(
)、c(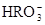 )、c(
)、c(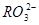 )分别相等
)分别相等
Ⅰ.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量的变化.
(1)为探究反应原理,现进行如下实验:T1℃时,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如右下图所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)= mol?L-1?min-1.
(2)该反应平衡常数K的表达式为 .
(3)温度变为T2℃(T1>T2),平衡常数K (填“增大”、“不变”或“减小”).
(4)不能判断该反应是否达到化学平衡状态的依据是 .
A.容器中压强不变 B.混合气体中 c(CO2)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有 .
A.升高温度; B.加入催化剂; C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2; E.充入He(g),使体系总压强增大.
Ⅱ.在温度t℃下,某NaOH的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12
该温度下水的离子积Kw= ;t 25℃(填“大于”、“小于”或“等于”).向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如表所示.
假设溶液混合前后的体积变化忽略不计,则c为 .

 查看习题详情和答案>>
查看习题详情和答案>>
 CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量的变化.(1)为探究反应原理,现进行如下实验:T1℃时,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如右下图所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)= mol?L-1?min-1.
(2)该反应平衡常数K的表达式为 .
(3)温度变为T2℃(T1>T2),平衡常数K (填“增大”、“不变”或“减小”).
(4)不能判断该反应是否达到化学平衡状态的依据是 .
A.容器中压强不变 B.混合气体中 c(CO2)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有 .
A.升高温度; B.加入催化剂; C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2; E.充入He(g),使体系总压强增大.
Ⅱ.在温度t℃下,某NaOH的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12
该温度下水的离子积Kw= ;t 25℃(填“大于”、“小于”或“等于”).向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如表所示.
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |

 查看习题详情和答案>>
查看习题详情和答案>>