网址:http://m.1010jiajiao.com/timu3_id_33978[举报]
已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++
CH3COO- Ka=1.8×10-5
H++
CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
查看习题详情和答案>>
已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。 查看习题详情和答案>>
下列说法正确的是( )
①用25mL酸式滴定管可以准确放出8.00mL的稀盐酸;
②可用干燥的pH试纸测定氯水的pH;
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大;
④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO![]() 存在;
存在;
⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
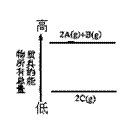
⑥下图是反应物和生成物的能量变化示意图,其可能发生反应的热化学方程式可表示为:2A(g)+B(g) ![]() 2C(g);△H=QkJ?mol-1(Q<0)。
2C(g);△H=QkJ?mol-1(Q<0)。

A.①③⑥ B.②④⑤ C.①③④ D.③⑤⑥
查看习题详情和答案>>(08山东一模)下列说法正确的是( )
①用25mL酸式滴定管可以准确放出8.00mL的稀盐酸;
②可用干燥的pH试纸测定氯水的pH;
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大;
 ④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO
④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO![]() 存在;
存在;
⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液 呈碱性时,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
⑥右图是反应物和生成物的能量变化示意图,其可能发生反应的热化学方程式可表示为:2A(g)+B(g) ![]() 2C(g); △H=QkJ?mol-1(Q<0)
2C(g); △H=QkJ?mol-1(Q<0)
A.①③④ B.②④⑤ C.①③⑥ D.③⑤⑥
查看习题详情和答案>>|
下列说法正确的是 ①用25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸; ②可用干燥的pH试纸测定氯水的pH; ③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大; ④加入盐酸有使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO ⑤在某温度下,醋酸与氢氧化钠溶液混合,溶液呈碱性,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+); ⑥下图是反应物和生成物的能量示意图,其可能发生反应的热化学方程式:2A(g)+B(g)
| |
A. |
①③⑥ |
B. |
②④⑤ |
C. |
①③④ |
D. |
③⑤⑥ |
