摘要:25.A 分析:
网址:http://m.1010jiajiao.com/timu3_id_338911[举报]
分析某种煤气的体积组成如下:H2 50%、CH4 30%、CO 10%、N2 6%、CO2 4%.
已知:H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
CO(g)+
O2(g)═CO2(g)△H=-282.6kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
则在标准状况下,224L该种煤气燃烧时放出的热量为( )
已知:H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
则在标准状况下,224L该种煤气燃烧时放出的热量为( )
查看习题详情和答案>>
分析下图装置,回答问题:
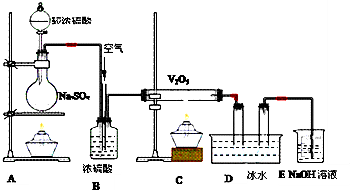
(1)装置A的烧瓶中发生的反应的化学方程式为
(2)装置C的直玻管中发生的反应的化学方程式为
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是
(4)装置E中NaOH的作用是
(5)B装置的作用很多,除了可以混匀气体外,还可以:
查看习题详情和答案>>

(1)装置A的烧瓶中发生的反应的化学方程式为
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
,(2)装置C的直玻管中发生的反应的化学方程式为
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
,
| ||
| △ |
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是
SO3
SO3
,(4)装置E中NaOH的作用是
吸收尾气
吸收尾气
,反应的离子方程式为SO2+2OH-=SO32-+2H2O
SO2+2OH-=SO32-+2H2O
;(5)B装置的作用很多,除了可以混匀气体外,还可以:
与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1(SO2与O2的气泡之比为2:1)
与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1(SO2与O2的气泡之比为2:1)
;干燥气体
干燥气体
.分析比较:
(1)绿色食品;白色污染;赤潮;蓝矾.与颜色有关的物质是
(2).Fe(OH)3胶体区别于FeCl3溶液最本质的特征是
(3)处于下列状态的物质中不能导电但属于电解质的有:
A.氯化钠晶体 B.干冰 C.冰醋酸 D.铜 E.硫酸钡晶体 F.蔗糖 G.酒精 H.熔融的硝酸钾 J.氯化氢气体 K.氢氧化钠溶液.
查看习题详情和答案>>
(1)绿色食品;白色污染;赤潮;蓝矾.与颜色有关的物质是
白色污染、赤潮、蓝矾
白色污染、赤潮、蓝矾
(2).Fe(OH)3胶体区别于FeCl3溶液最本质的特征是
分散质微粒直径大小在1~100nm之间
分散质微粒直径大小在1~100nm之间
.(填:丁达尔效应、微粒直径大小在1~100nm之间、均一的分散系、电泳、聚沉、分散质能通过滤纸、)(3)处于下列状态的物质中不能导电但属于电解质的有:
J
J
填序号).A.氯化钠晶体 B.干冰 C.冰醋酸 D.铜 E.硫酸钡晶体 F.蔗糖 G.酒精 H.熔融的硝酸钾 J.氯化氢气体 K.氢氧化钠溶液.
分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液).
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.
①当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)
②当a=10,n=1时,A溶液中各种离子浓度由大到小的顺序为
当a=11,n=2时,A溶液中各种离子浓度由大到小的顺序为
③当n=1、c=0.1,溶液中c(HB):c(B-)=1:99时,A溶液的pH为
(2)已知难溶电解质A的化学式为X2Y3,测得其饱和溶液中X3+离子的浓度为c mol/L,则该难溶物X2Y3的溶度积常数为Ksp=
c5
c5.
查看习题详情和答案>>
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a.
①当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)
Bn-+H2O?HB(n-1)-+OH-
Bn-+H2O?HB(n-1)-+OH-
.②当a=10,n=1时,A溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(B-)>c(OH-)>c(H+)
c(Na+)>c(B-)>c(OH-)>c(H+)
,c(OH-)-c(HB)=1×10-10
1×10-10
mol/L.当a=11,n=2时,A溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
,当a=9,n=2时,NaHB的溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
,当a=6,n=2时,NaHB溶液呈酸性的原因是(用离子方式程式表示)HB-+H2O?B2-+H3O+
HB-+H2O?B2-+H3O+
,NaHB的溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
.③当n=1、c=0.1,溶液中c(HB):c(B-)=1:99时,A溶液的pH为
11
11
(保留整数值).(2)已知难溶电解质A的化学式为X2Y3,测得其饱和溶液中X3+离子的浓度为c mol/L,则该难溶物X2Y3的溶度积常数为Ksp=
| 27 |
| 8 |
| 27 |
| 8 |
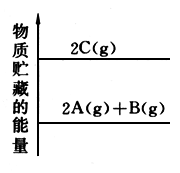
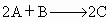 ΔH<0
ΔH<0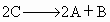 ΔH<0
ΔH<0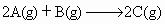 ΔH>0
ΔH>0