摘要:4.在O℃.1.O1×l05Pa的条件下.等体积的下列物质质量最大的是( ) A.水 B.氢气 C.二氧化碳 D.氯气
网址:http://m.1010jiajiao.com/timu3_id_338520[举报]
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:(1)“O”点导电能力为0的理由是
在“O”点处醋酸未电离,无离子存在
在“O”点处醋酸未电离,无离子存在
;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为
c<a<b
c<a<b
;(3)a、b、c三点处,电离程度最大的是
c
c
;(4)若使c(CH3COO-)增大,溶液c(H+)减小,可采取的措施是:①
加少量NaOH固体
加少量NaOH固体
;②加少量Na2CO3固体
加少量Na2CO3固体
;③加入Zn、Mg等金属
加入Zn、Mg等金属
. Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如下图所示,甲、乙之间的隔板K和活塞F都可左右自由移动,甲充入2molA和1molB,乙中充入2molC和1molHe,只有A为有色气体,此时K停在O处.在一定条件下发生逆反应:2A(g)+B(g)?2C(g)△H<0;反应达到平衡后,再恢复至原温度.回答下列问题:(1)该反应的平衡常数表达式为K=
(2)可根据
(3)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范是
(4)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为
Ⅱ.接上题,若一开始就将K、F同定,其他条件均与Ⅰ相同,请完成下列问题:
(1)当甲中的下列物理量不再变化时,能表明甲中反应已达平衡的是
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体的总物质的量
(2)达到平衡时,甲、乙中C的物质的量的关系是
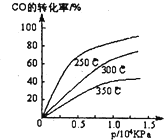 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g)(1)不同温度下的平衡转化率与压强的关系如图所示.
①该反应△H
②实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是
(2)某温度下,将2molCO和6mOlH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=O.1 mol?L-1.
①该反应的平衡常数K=
②在其他条件不变的情况下,将容器体积压缩到原来的
| 1 |
| 2 |
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时
| n(H2) |
| n(CH3OH) |
③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH3OH,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为
 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.第①步:将硼镁矿用浓碱NaOH溶液溶解,过滤得NaBO2溶液.
第②步:将NaBO2浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7?10H2O.
第③步:将硼砂溶于水后,用H2SO4调节酸度,过滤得H3BO3晶体.
第④步:加热硼酸使之脱水生成氧化物.
第⑤步:脱水产物用镁还原即得粗单质硼.请回答下列问题:
(1)第①步和第⑤步的化学方程式分别为
(2)将制得的粗硼在一定条件下反应全部生成BI3,然后BI3热分解可以得到纯净的单质硼.0.20g粗硼制成的BI3分解得到的I2全部被收集后,用 2.00mol/LNa2S2O3溶液滴定,用去27.00mL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-).
①Na2S2O3溶液成碱性,用离子方程式表达其原因
②粗硼中硼的含量为
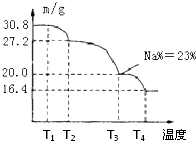
(3)上述制得的硼砂晶体(Na2B4O7?10H2O)还可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.已知纯品过硼酸钠晶体中各元素的物质的量之比为n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如下图所示,则T3时所得晶体的化学式为: