摘要:96.下面是四种盐在不同温度下的溶解度 NaNO3 KNO3 NaCl KCl 10℃ 80.5 20.9 35.7 31.0 100℃ 175 246 39.1 56.6 (计算时假定:①盐类共存时不影响各自的溶解度,②过滤晶体时.溶剂损耗忽略不计.) (1)取23.4克NaCl和40.4克KNO3.加70.0克H2O.加热溶解.在100℃时蒸发掉50.0克H2O.维持该温度.过滤出晶体.计算所得晶体的质量(m高温).将滤液冷却至10℃.待充分结晶后.过滤.计算所得晶体的质量(m低温). (2)另取34.0克NaNO3和29.8克KCl.同样进行如上实验.10℃时析出的晶体是 (写化学式).100℃和10℃得到的晶体质量(m¢高温和m¢低温)分别是多少? 答案:=15.6g m=36.9g (2)KNO3和NaCl m¢=15.6g m¢=36.9g
网址:http://m.1010jiajiao.com/timu3_id_336970[举报]
(1998年全国,35)下面是四种盐在不同温度下的溶解度(g/100 g H2O)
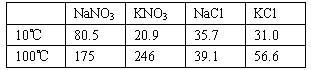
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计。)
(1)取23.4 g NaCl和40.4 g KNO3,加70.0 g H2O,加热溶解。在100℃时蒸发掉50.0 g H2O,维持该温度,过滤析出晶体,计算所得晶体的质量(![]() )。
)。
将滤液冷却至10℃,待充分结晶后,过滤。计算所得晶体的质量(![]() )。
)。
(2)另取34.0 g NaNO3和29.8 g KCl,同样进行如上实验。10℃时析出的晶体是 (写化学式)。100℃和10℃得到的晶体质量(m′高温和m′低温)分别是多少?
查看习题详情和答案>>
(1997年全国,35)8.8 g FeS固体置于200 mL 2.0 mol·L-1的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10 mol·L-1,假定溶液体积不变,试计算:
(1)收集到的H2S气体的体积(标准状况)。
(2)溶液中Fe2+和H+的物质的量浓度(摩尔浓度)。
查看习题详情和答案>>
分析下列物质的物理性质,判断其晶体类型。
A.碳化铝,黄色晶体,熔点2200 ℃,熔融状态下不导电:__________________________。
B.溴化铝,无色晶体,熔点98 ℃,熔融状态下不导电:____________________________。
C.五氟化钒,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中:_________________。
D.溴化钾,无色晶体,熔融时或溶于水中都能导电:_________________________________。
查看习题详情和答案>>