摘要:3.常见类型 (1)平衡建立的过程图 [例1]600℃时.A.B.C三种气体在密闭容器中浓度的变化情况如图所示.仅从图上分析不能得出有关A的结论的是( ) A.A是反应物 B.前4minA是分解速率是0.1 mol/ C.4min后.若升高温度.A的转化率增大. D.4min后.若增大压强.A的转化率减小. (2)速率(v)-时间(t)图(简称v- t图) [例2]对于已达到平衡的可逆反应:N2(g)+3H2(g)2NH3(g),ΔH<0.为使正逆反应速率符合右图.应采取的措施是( ) A.增大N2的浓度 B.升高温度 C.增大压强 D.增大NH3的浓度 (3)量值-条件-时间图 [例3]在一定温度不同压强(p1<p2)下.可逆反应2X(g)2Y中.生成物Z在反应混合物中的体积分数()与反应时间(t)的关系有以下图示.正确的是 (4)量值-条件图 [例4]对于mA(s)+nB(g)pC(g),ΔH<0的可逆反应.在一定温度下B的百分含量与压强的关系如图所示.则下列判断正确的是( ) A.m+n<p B.n>p C.x点的状态是v正>v逆 D.x点比y点的反应速率慢 (5)量值-时间图 [例5]在容积固定的密闭容器中存在如下反应:A2C(g),ΔH<0.某研究小组研究了其他条件不变时.改变某一条件对上述反应的影响.并根据实验数据作出下列关系图: 下列判断一定错误的是 A.图Ⅰ研究的是不同催化剂对反应的影响.且乙使用的催化剂效率较高 B.图Ⅱ研究的是压强对反应的影响.且甲的压强较高 C.图Ⅱ研究的是温度对反应的影响.且甲的温度较高 D.图Ⅲ研究的是不同催化剂对反应的影响.且甲使用的催化剂效率较高 (6)速率-条件图 [例6]图中C%表示某反应物在体系中的百分含量.v表示反应速率.p表示压强.t表示反应时间.图Ⅰ为温度一定时压强与反应速率的关系曲线,图Ⅱ为压强一定时.在不同时间C%与温度的关系曲线.同时符合以下两个图像的反应是( ) A.4NH3(g)+5O2(g)4NO(g)+6H2O(g),ΔH<0 B.N2O3(g)NO2,ΔH>0 C.3NO2(g)+H2O(l)2HNO3,ΔH<0 D.2CO(g)CO2,ΔH<0
网址:http://m.1010jiajiao.com/timu3_id_336324[举报]
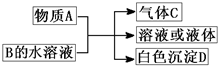 (2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.(1)若A是碳化钙,A与B的水溶液反应时只生成气体C、CaCO3和H2O.则B(只含两种元素)的化学式为
CO2
CO2
,其固态时的晶体为分子
分子
晶体;C分子中含有的化学键类型是极性键和非极性键
极性键和非极性键
.(2)若A是短周期中原子半径最大的元素的单质,D既可溶于NaOH溶液又可溶于盐酸.请写出:
①D溶于盐酸的离子方程式
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.②工业上冶炼A的化学方程式
2NaCl
2Na+Cl2↑
| ||
2NaCl
2Na+Cl2↑
.
| ||
③实验室用惰性电极电解100mL 0.1mol/L A的氯化物的水溶液(滴有酚酞),一段时间后,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为
13
13
(忽略反应前后溶液的体积变化).某电极附近溶液颜色变红,原因是氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度
氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度
,则该电极与外接直流电源的负
负
极相连接(填“正”、或“负”).(3)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则反应的化学方程式是
Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O
Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O
.(4)若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是
H2SiO3
H2SiO3
.A、B、C均为常见的物质,且有如下转化关系:
(1)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子.
①请用离子方程式表示C溶液呈现酸碱性的原因:
②用石墨电极电解B的饱和溶液时,观察到的现象是
阳极反应式为
(2)若A、B、C均为含硫元素的物质,则A分子中的化学键类型是
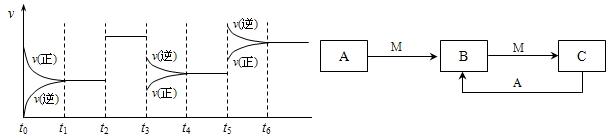
①若C在一定条件下可发生如下的反应:2SO2+O2 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
A t2时加入了催化剂 B t3时降低了温度
C t5时增大了压强 D t4~t5时间内反应物的转化率最低
②一定温度下的密闭容器内,充入4mol SO2、2mol O2 发生反应2SO2+O2 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
等温等容时再充入2mol SO2、1mol O2,达到平衡时若SO3的体积分数为b%,SO2的转化率为n,则a
查看习题详情和答案>>

(1)若M是第IVA族某元素的最高价氧化物,且M为气体,组成A的阴阳离子均含有10个电子.
①请用离子方程式表示C溶液呈现酸碱性的原因:
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 H2CO3+OH-
H2CO3+OH-HCO3-+H2O H2CO3+OH-
H2CO3+OH-
. H2CO3+OH-
H2CO3+OH-②用石墨电极电解B的饱和溶液时,观察到的现象是
阴阳两极均有气体放出,溶液变浑浊或有晶体析出
阴阳两极均有气体放出,溶液变浑浊或有晶体析出
,阳极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,电解一段时间后,溶液的pH不变
不变
(填“增大”、“减小”或“不变”).(2)若A、B、C均为含硫元素的物质,则A分子中的化学键类型是
极性共价键
极性共价键
.①若C在一定条件下可发生如下的反应:2SO2+O2
 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是A
A
.A t2时加入了催化剂 B t3时降低了温度
C t5时增大了压强 D t4~t5时间内反应物的转化率最低
②一定温度下的密闭容器内,充入4mol SO2、2mol O2 发生反应2SO2+O2
 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 等温等容时再充入2mol SO2、1mol O2,达到平衡时若SO3的体积分数为b%,SO2的转化率为n,则a
<
<
b,m<
<
n(填“>”、“=”或“<”,下同).若改为等温等压,则a═
═
b,m═
═
n.(2012?东城区一模)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素.又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体.
请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:
(3)一定条件下,A的单质气体与B的单质气体充分反应生成3.4gW气体已知[n(A):n(B)=3:1],可以放出9.22kJ热量,则该反应的热化学方程式为
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为
(5)在10L的密闭容器中,通入2mol FC2气体和1mol C2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.01mol/L,则平衡时FC2的转化率为
查看习题详情和答案>>
请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
离子键、共价键
离子键、共价键
,用离子方程式表示X溶液呈酸性的原因是NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
.(3)一定条件下,A的单质气体与B的单质气体充分反应生成3.4gW气体已知[n(A):n(B)=3:1],可以放出9.22kJ热量,则该反应的热化学方程式为
N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
.(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为
H2-2e-+2OH-=2H2O
H2-2e-+2OH-=2H2O
.(5)在10L的密闭容器中,通入2mol FC2气体和1mol C2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.01mol/L,则平衡时FC2的转化率为
90%
90%
. (2010?柳州三模)A、B、C、D是由前18号元素组成的四种常见化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图反应关系:
(2010?柳州三模)A、B、C、D是由前18号元素组成的四种常见化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图反应关系:(1)上述转化过程中包含的反应类型为
bc
bc
.a置换反应 b化合反应 c分解反应 d复分解反应
(2)乙在甲中燃烧,当有1mol e-转移,生成液态A时,放出142.9kJ的热量,写出该反应的热化学方程式:
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol
.| 1 |
| 2 |
(3)反应③在一定条件下为可逆反应,经过一段时间该反应达到
平衡,写出该反应的化学方程式:
2NO+O2?2NO2
2NO+O2?2NO2
.若将3mol甲和4mol C混合充入容积为2L的密闭容器中,2分钟后,达到平衡.平衡后混合气总物质的量为6mol,甲的化学反应速率为
0.25mol/(L?min)
0.25mol/(L?min)
.将该平衡混和物缓慢通入水中得到1L溶液,所得溶液物质的量浓度是4mol/L
4mol/L
.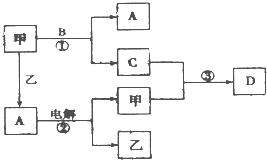 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:(1)上述转化过程中包含的反应类型有
BC
BC
(填序号)A.置换反应B.化合反应C.分解反应D.复分解反应
(2)在反应②中,阳极的电极反应方程式为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;(3)乙在甲中燃烧,当有1mol电子转移,生成液态A时,放出142.9kJ的热量,则该反应的热化学方程式为
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
;(4)反应③在一定条件下为可逆反应,若将3mol甲和4molC混合充入2L的密闭容器中,2min后达到平衡.平衡后混合气体的总物质的量为6mol,则甲的反应速率为
0.25mol/(L.min)
0.25mol/(L.min)
,该平衡混合气体溶于水,恰好完全被水吸收,该反应的总化学方程式为NO+NO2+O2+H2O═HNO3
NO+NO2+O2+H2O═HNO3
.(5)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将气体B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式:
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
;②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
.