摘要:(1)CO2(或SO2).H2S.Al2(SO4)3中任两种, (2)Cl2(或Br2.NO2).A中R的化合价必须介于B.C中R的化合价之间.
网址:http://m.1010jiajiao.com/timu3_id_336225[举报]
NO2,SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.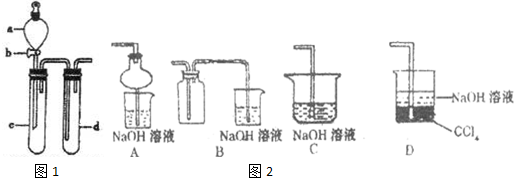
(1)下列有关酸雨的说法正确的是
A.SO、NO2或CO2都会导致酸雨的形成
B.NO不溶于水,所以不会造成酸雨污染
C.燃煤时鼓入足量空气,可以减少酸雨的产生
D.采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究,NO2 SO2气体的性质.
①下列实验方案适用于图所示装置制取所需SO2,NO2的是
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.将NO与氧气在C中混合 D.铜与浓HNO3
②组装完仪器,检查装置气密性后,在试管c中加入Cu现象为:
③若要证明c中生成的气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2装置,其中可能不合理的是
⑤小组同学设计在试管d中加入下列试剂验证SO2的性质,写出分别验证那些性质:
KMnO4:
查看习题详情和答案>>

(1)下列有关酸雨的说法正确的是
D
D
(填序号)A.SO、NO2或CO2都会导致酸雨的形成
B.NO不溶于水,所以不会造成酸雨污染
C.燃煤时鼓入足量空气,可以减少酸雨的产生
D.采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究,NO2 SO2气体的性质.
①下列实验方案适用于图所示装置制取所需SO2,NO2的是
BD
BD
(填序号)A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.将NO与氧气在C中混合 D.铜与浓HNO3
②组装完仪器,检查装置气密性后,在试管c中加入Cu现象为:
固体逐渐溶解,溶液变蓝,产生红棕色气体
固体逐渐溶解,溶液变蓝,产生红棕色气体
③若要证明c中生成的气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液
红色褪去
红色褪去
后,再加热
加热
(填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2.④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2装置,其中可能不合理的是
BC
BC
(填序号).⑤小组同学设计在试管d中加入下列试剂验证SO2的性质,写出分别验证那些性质:
KMnO4:
还原性
还原性
;有酚酞的烧碱溶液:酸性
酸性
;H2S溶液:氧化性
氧化性
.(2013?德州一模)氮及其化合物在工农业生产、生活中有者重要作用.请回答下列问题:

(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能星变化示意图(a、b均大 于0>,且知:
2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ?mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N2)=0.1mol?L-1,c(H2)=0.3mol?L-1;合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0
①计算在a达平衡时H2的转化率为
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是
(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
①试确定K1的相对大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内NH3的浓度保持不变 B.2v( N2)(正)-v( H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)
②25°C时,将PH=x氨水与pH=y的疏酸(且x+y-14,x>11 )等体积混合后,所得溶液 中各种离子的浓度关系正确的是
A.[SO
]>[NH
]>[H+]>[OH-]
B.[NH
]>[SO
]>[OH-]>[H+]
C.[NH
]+[H+]>[SO
]+[OH-]
D.[NH
]>[SO
]>[H+]>[OH-].
查看习题详情和答案>>

(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能星变化示意图(a、b均大 于0>,且知:
2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ?mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式
4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)KJ/mol
4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)KJ/mol
;(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N2)=0.1mol?L-1,c(H2)=0.3mol?L-1;合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0
①计算在a达平衡时H2的转化率为
40%
40%
;②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是
升高温度
升高温度
;试写出判断b与a条件不同的理由因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以ba条件下达到平衡状态氮气的浓度相同
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以ba条件下达到平衡状态氮气的浓度相同
;(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
<
<
4.1x106(填写“>”“-”或“<”)②下列各项能作为判断该反应达到化学平衡状态的依据的是
AC
AC
(填序号字母).A.容器内NH3的浓度保持不变 B.2v( N2)(正)-v( H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.②25°C时,将PH=x氨水与pH=y的疏酸(且x+y-14,x>11 )等体积混合后,所得溶液 中各种离子的浓度关系正确的是
A.[SO
2- 4 |
+ 4 |
B.[NH
+ 4 |
2- 4 |
C.[NH
+ 4 |
2- 4 |
D.[NH
+ 4 |
2- 4 |
某科研小组用MnO2和浓盐酸制备Cl2并以氯气为原料进行氯气的性质实验,装置如图:其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液)、F(水)、H(紫色石蕊试液).

(1)Ⅰ中b瓶内加入的液体最好是
图示的Ⅱ或Ⅲ能代替Ⅰ的是
(2)G装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①B装置中的现象是
②怎样证明氯气已充满了整个装置?
③G中反应的化学方程式:
(3)某同学利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设
假设1:只存在SO
;
假设2:既不存在SO
,也不存在ClO-;
假设3:
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4、1mol/L NaOH、0.01mol/L KMnO4、淀粉KI溶液、紫色石蕊试液.
查看习题详情和答案>>

(1)Ⅰ中b瓶内加入的液体最好是
饱和食盐水
饱和食盐水
,装置Ⅰ的作用是贮存多余的Cl2
贮存多余的Cl2
;图示的Ⅱ或Ⅲ能代替Ⅰ的是
Ⅱ
Ⅱ
.(2)G装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①B装置中的现象是
溶液呈蓝色
溶液呈蓝色
.②怎样证明氯气已充满了整个装置?
当整个装置内充满黄绿色气体时,说明氯气已充满整个装置溶液由浅绿
当整个装置内充满黄绿色气体时,说明氯气已充满整个装置溶液由浅绿
.③G中反应的化学方程式:
C+2H2O+2Cl2
CO2+4HCl
| ||
C+2H2O+2Cl2
CO2+4HCl
.H装置中的现象是
| ||
紫色石蕊试液的颜色由紫色变为红色,再变为无色
紫色石蕊试液的颜色由紫色变为红色,再变为无色
.(3)某同学利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO
2- |
①提出合理假设
假设1:只存在SO
2- 3 |
假设2:既不存在SO
2- 3 |
假设3:
只存在ClO-
只存在ClO-
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4、1mol/L NaOH、0.01mol/L KMnO4、淀粉KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ----- |
| 步骤2: | |
| 步骤3: |
化学反应原理在工业生产中具有十分重要的意义.
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如图:
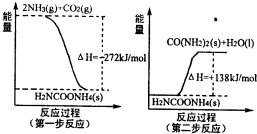
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 .
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=akJ.mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”).在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4mol,则5min后达到平衡时CO2的转化率为
,生成CO的平均速率v(CO)为 .
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填字母).
A.缩小反应器容积 B.增加Fe的物质的量
C.升高温度到900℃D.使用合适的催化剂
(3)硫酸厂常用NaOH溶液吸收SO2废气.当吸收液呈中性时,溶液中离子浓度关系正确的是[已知n(SO
):n(HSO
)=1:1时,pH=7.2](填字母) .
A、c(Na+)=2c(SO
)+c(HSO
)
B、c(Na+)>c(HSO
)>c(SO
)>c(H+)=c(OH-)
C、c(Na+)+c(H+)=c(SO
)+c(HSO
)+c(OH-)
查看习题详情和答案>>
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如图:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=akJ.mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器容积 B.增加Fe的物质的量
C.升高温度到900℃D.使用合适的催化剂
(3)硫酸厂常用NaOH溶液吸收SO2废气.当吸收液呈中性时,溶液中离子浓度关系正确的是[已知n(SO
2- 3 |
- 3 |
A、c(Na+)=2c(SO
2- 3 |
- 3 |
B、c(Na+)>c(HSO
- 3 |
2- 3 |
C、c(Na+)+c(H+)=c(SO
2- 3 |
- 3 |
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:
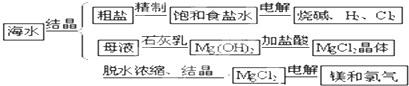
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性.请写出加入盐酸后发生反应的离子方程式 .
(2)海水里的镁元素处于 (游离、化合)态,从海水中提取氯化镁的反应 (“是”或“不是”)氧化还原反应,理由 .
(3)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液里加入石灰乳的作用是 .
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却
A.H2 B.CO2 C.空气 D.O2.
查看习题详情和答案>>

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
2- 4 |
(2)海水里的镁元素处于
(3)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液里加入石灰乳的作用是
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却
A.H2 B.CO2 C.空气 D.O2.