题目内容
NO2,SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.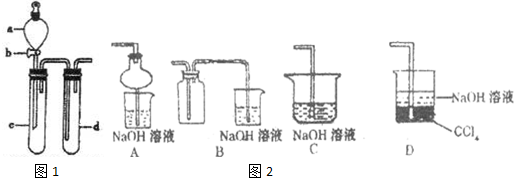
(1)下列有关酸雨的说法正确的是
A.SO、NO2或CO2都会导致酸雨的形成
B.NO不溶于水,所以不会造成酸雨污染
C.燃煤时鼓入足量空气,可以减少酸雨的产生
D.采用清洁能源,可以减少酸雨的产生
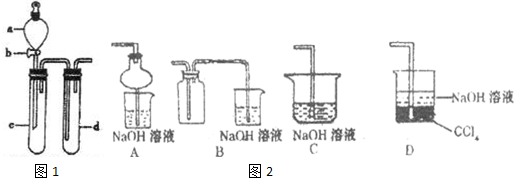
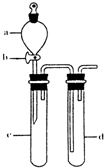
(2)某兴趣小组采用右图装置制取并探究,NO2 SO2气体的性质.
①下列实验方案适用于图所示装置制取所需SO2,NO2的是
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.将NO与氧气在C中混合 D.铜与浓HNO3
②组装完仪器,检查装置气密性后,在试管c中加入Cu现象为:
③若要证明c中生成的气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液
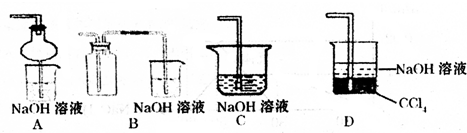
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2装置,其中可能不合理的是
⑤小组同学设计在试管d中加入下列试剂验证SO2的性质,写出分别验证那些性质:
KMnO4:

(1)下列有关酸雨的说法正确的是
D
D
(填序号)A.SO、NO2或CO2都会导致酸雨的形成
B.NO不溶于水,所以不会造成酸雨污染
C.燃煤时鼓入足量空气,可以减少酸雨的产生
D.采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究,NO2 SO2气体的性质.
①下列实验方案适用于图所示装置制取所需SO2,NO2的是
BD
BD
(填序号)A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.将NO与氧气在C中混合 D.铜与浓HNO3
②组装完仪器,检查装置气密性后,在试管c中加入Cu现象为:
固体逐渐溶解,溶液变蓝,产生红棕色气体
固体逐渐溶解,溶液变蓝,产生红棕色气体
③若要证明c中生成的气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液
红色褪去
红色褪去
后,再加热
加热
(填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2.④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2装置,其中可能不合理的是
BC
BC
(填序号).⑤小组同学设计在试管d中加入下列试剂验证SO2的性质,写出分别验证那些性质:
KMnO4:
还原性
还原性
;有酚酞的烧碱溶液:酸性
酸性
;H2S溶液:氧化性
氧化性
.分析:(1)依据酸雨的形成过程和原因进行分析,污染和治理方法的判断;
(2)装置制取并探究,NO2 SO2气体的性质;
①依据实验方案适用于图所示装置分析制取所需SO2,NO2的方法和装置选择;
②依据气体制备的原料和原理分析判断;
③根据二氧化硫气体的检验方法分析判断;
④依据尾气成分选择吸收的试剂,装置中需要防止倒吸;
⑤依据试剂的性质分析和二氧化硫反应时,元素化合价的变化分析氧化还原性,依据反应特征判断二氧化硫的化学性质;
(2)装置制取并探究,NO2 SO2气体的性质;
①依据实验方案适用于图所示装置分析制取所需SO2,NO2的方法和装置选择;
②依据气体制备的原料和原理分析判断;
③根据二氧化硫气体的检验方法分析判断;
④依据尾气成分选择吸收的试剂,装置中需要防止倒吸;
⑤依据试剂的性质分析和二氧化硫反应时,元素化合价的变化分析氧化还原性,依据反应特征判断二氧化硫的化学性质;
解答:解:(1 )A、SO2、NO2都会导致酸雨的形成,二氧化碳溶于水形成的是弱酸且水溶液中不稳定分解,不形成酸雨,CO2会形成温室效应,故A错误;
B、NO不溶于水,但会在放电时和氧气反应生成二氧化氮,溶于水生成硝酸,会造成酸雨污染,故B错误;
C、燃煤时鼓入足量空气,只能使燃料燃烧充分,不能减少二氧化硫的排放,不能减少酸雨的产生,故C错误;
D、采用清洁能源,减少二氧化硫等污染气体的排放,可以减少酸雨的产生,故D正确;
故答案为:D
(2)①实验方案适用于图所示装置,必须是固体和液体不加热反应生成制取所需SO2,NO2的;
A、Na2SO3溶液与HNO3反应时,硝酸会氧化亚硫酸钠本身被还原为一氧化氮,故A不符合;
B、Na2SO3固体与浓硫酸不加热反应,利用浓硫酸难挥发性可以反应生成二氧化硫气体,故B符合;
C、将NO与氧气在C中混合不发生反应,一氧化氮和氧气必须在放电条件反应,故C不符合;
D、铜与浓HNO3反应生成二氧化氮气体,符合装置要求,故D符合;
故选BD.
故答案为:BD
②在试管c中加入Cu,则分液漏斗中使浓硝酸,铜溶于浓硝酸生成硝酸铜二氧化氮和水;所以现象为:固体逐渐溶解,溶液变蓝,产生红棕色气体;
故答案为:固体逐渐溶解,溶液变蓝,产生红棕色气体;
③若要证明c中生成的气体是SO2,依据二氧化硫能使品红试液褪色,加热恢复红色;d中加入品红溶液后,打开活塞b,反应开始,待d中溶液红色褪去,再加热试管d中的溶液,颜色又恢复,证明气体是SO2;故答案为:红色褪去; 加热;
④增加一尾气吸收装置防止污染性气体排放到空气中,装置需要很好地吸收气体,又能防止倒吸,BC易发生倒吸,AD可以吸收尾气,也可以防倒吸,故答案为:BC.
⑤加入下列试剂验证SO2的性质,KMnO4和二氧化硫反应,能把二氧化硫氧化为硫酸,所以验证的是二氧化硫的还原性;有酚酞的烧碱溶液通入二氧化硫会生成亚硫酸钠和水,溶液红色变浅或褪去,证明二氧化硫的酸性;H2S溶液和二氧化硫反应生成硫单质和水,表现了二氧化硫的氧化性;故答案为:还原性; 酸性;氧化性.
B、NO不溶于水,但会在放电时和氧气反应生成二氧化氮,溶于水生成硝酸,会造成酸雨污染,故B错误;
C、燃煤时鼓入足量空气,只能使燃料燃烧充分,不能减少二氧化硫的排放,不能减少酸雨的产生,故C错误;
D、采用清洁能源,减少二氧化硫等污染气体的排放,可以减少酸雨的产生,故D正确;
故答案为:D
(2)①实验方案适用于图所示装置,必须是固体和液体不加热反应生成制取所需SO2,NO2的;
A、Na2SO3溶液与HNO3反应时,硝酸会氧化亚硫酸钠本身被还原为一氧化氮,故A不符合;
B、Na2SO3固体与浓硫酸不加热反应,利用浓硫酸难挥发性可以反应生成二氧化硫气体,故B符合;
C、将NO与氧气在C中混合不发生反应,一氧化氮和氧气必须在放电条件反应,故C不符合;
D、铜与浓HNO3反应生成二氧化氮气体,符合装置要求,故D符合;
故选BD.
故答案为:BD
②在试管c中加入Cu,则分液漏斗中使浓硝酸,铜溶于浓硝酸生成硝酸铜二氧化氮和水;所以现象为:固体逐渐溶解,溶液变蓝,产生红棕色气体;
故答案为:固体逐渐溶解,溶液变蓝,产生红棕色气体;
③若要证明c中生成的气体是SO2,依据二氧化硫能使品红试液褪色,加热恢复红色;d中加入品红溶液后,打开活塞b,反应开始,待d中溶液红色褪去,再加热试管d中的溶液,颜色又恢复,证明气体是SO2;故答案为:红色褪去; 加热;
④增加一尾气吸收装置防止污染性气体排放到空气中,装置需要很好地吸收气体,又能防止倒吸,BC易发生倒吸,AD可以吸收尾气,也可以防倒吸,故答案为:BC.
⑤加入下列试剂验证SO2的性质,KMnO4和二氧化硫反应,能把二氧化硫氧化为硫酸,所以验证的是二氧化硫的还原性;有酚酞的烧碱溶液通入二氧化硫会生成亚硫酸钠和水,溶液红色变浅或褪去,证明二氧化硫的酸性;H2S溶液和二氧化硫反应生成硫单质和水,表现了二氧化硫的氧化性;故答案为:还原性; 酸性;氧化性.
点评:本题考查了氮氧化物、硫及其化合物性质的应用,气体实验制备方法,装置注意问题,主要考查二氧化硫的氧化性,还原性,漂白性等性质的实验设计和现象判断,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.