网址:http://m.1010jiajiao.com/timu3_id_33581[举报]
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 | 密度:0.97g?cm-3 熔点:97.8℃ 能导电 | 沸点:-34.0℃ 不能导电 | 密度:1.43g?L-1 沸点:-183.0℃ 不能导电 | 熔点:3550℃ 能导电 |
(1)元素W在周期表中的位置______,根据性质描述,元素Z的单质是______(写名称),上述元素的简单离子中半径最小的是______(写离子符号).
(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:______(用化学式表示).
(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是______(选填序号).
a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为______,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式______.
查看习题详情和答案>>
已知亚硝酸(HNO2)是一种不稳定性弱酸,可以分解产生NO和HNO3,由于HNO2可以使人体血红蛋白中的Fe2+转化为Fe3+,所以对人体有害.请完成下列填空:
(1)在HNO2与Fe2+的反应中氧化剂是______.
(2)HNO2分解反应中氧化剂与还原剂的物质的量之比是______.
(3)HNO2与氢碘酸反应可产生碘单质和NO,写出该反应的离子方程式______.根据上述信息和已有知识,HNO2、Fe3+、I2氧化性由强到弱排序______.
(4)含HNO2的工业废水可以加入NH4Cl溶液处理,两者相遇会产生无色无味的单质气体,由此可见HNO3和HNO2的氧化性______比______强,当200mL1.0 mol?L-1HNO2溶液与含Cl-3.55g的NH4Cl溶液混合时,充分反应后,产生标准状况无色无味的单质气体______ L.此时______mol电子发生转移.
查看习题详情和答案>>
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为 。
H2C2O4的电离方程式为
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10 mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |
甲同学由此能够得出结论:
II.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”, 决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸。
(1) 欲准确测定菠菜中草酸盐含量,回答有关问题:
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液。每次移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,滴定实验重复操作2 —3次。平均消耗标准溶液V mL。
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为 。(只列式不计算,已知:C2O42-的的摩尔质量为88 g•mol-1)
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是 。
Ⅲ另一小组通过测定锌和不同浓度的稀硫酸反应来探究浓度对反应速率的影响(4mol/l稀硫酸,1 mol/l稀硫酸,Zn粒)。
所用装置如图:(1)如何检查该装置的气密性
(2)该实验除保证气密性良好外,还需注意: ,
(3)该小组同学所用实验时间相同,通过测定 来证明4mol/l稀硫酸反应速率快

Ⅳ.第四组完成温度对反应速度率的影响实验选择的药品为稀硫酸和硫代硫酸钠反应的方程式
为
查看习题详情和答案>>(14分)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 一 | ① |
| ||||||
| 二 |
|
|
| ② | ③ | ④ |
|
|
| 三 | ⑤ |
| ⑥ | ⑦ |
| ⑧ |
|
|
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、 。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:
①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c( )>c( )>c( )>c( )(在括号内填离子符号)。
查看习题详情和答案>>
(14分)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 一 | ① | | ||||||
| 二 | | | | ② | ③ | ④ | | |
| 三 | ⑤ | | ⑥ | ⑦ | | ⑧ | | |
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、 。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:
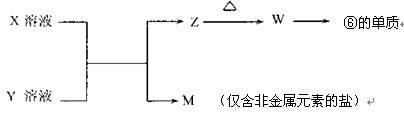
①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c( )>c( )>c( )>c( )(在括号内填离子符号)。 查看习题详情和答案>>