摘要:下列说法正确的是(NA表示阿伏加德罗常数的值) ( ) A.在常温常压下.11.2LN2含有的分子数为0.5NA B.在常温常压下.1molNe含有的原子数为NA C.71gCl2所含原子数为2NA D.在同温同压下.相同体积的任何气体单质所含的原子数相同
网址:http://m.1010jiajiao.com/timu3_id_335248[举报]
由甲酸、乙酸、乙二酸组成的混合物Xg,经完全燃烧生成标准状况下4.48L CO2气体;完全中和等质量的混合物消耗80ml,2mol/L的NaOH溶液,则X值可能为( )
| A、8.lg | B、7.85g | C、15.7g | D、5.4g |
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol?L-1,下列说法中正确的是( )
| A、当容器内混合气体的密度不再发生变化时,反应即达到平衡状态 | B、达平衡后若升高温度,该反应的平衡常数将增大 | C、平衡时反应物B的转化率为15.0% | D、达平衡后,如果此时移走2 mol A 和 1 mol B,在相同温度下再达平衡时C的浓度<0.3 mol?L-1 |
用下列装置能达到有关实验目的是( )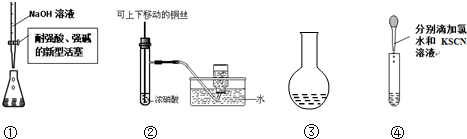

| A、用①量取15.00 mLNaOH溶液 | B、用②制备并收集少量NO2气体 | C、用③所示的仪器配制1L 0.1000mol/LNaCl溶液 | D、用④进行Fe2+的检验 |
将15.2gFe、Cu组成的合金溶于过量的稀硝酸中,生成4.48LNO(标准状况),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为( )
| A、33.2g | B、25.4g | C、22.4g | D、19.6g |
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)N的电极反应式为
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K=
 ,
,
②条件相同时,反应I与反应II相比,转化程度更大的是
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值
查看习题详情和答案>>

(1)N的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气
1.12
1.12
L(标准状况下).(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇
4.6
4.6
g.(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
| ||
反应II:2CO2(g)+4H2(g)
| ||
①写出反应I的平衡常数表达式K=


②条件相同时,反应I与反应II相比,转化程度更大的是
反应II
反应II
.③在一定压强下,测得反应I的实验数据如下表:
温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”或“不变”),提高氢碳比.n(H2)/n(CO2),对生成乙醇有利
有利
(填“不利”或“有利”).