网址:http://m.1010jiajiao.com/timu3_id_334020[举报]
(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g)
△H
CH3OH(g)
△H
已知某些化学键的键能数据如下表:
|
化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
|
键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的△H= ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
|
反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
|
压强/MPa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成nmolCO的同时生成2nmolH2
(Ⅱ)回答下列问题:
(1)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)

(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO−)-c(Na+)=____________mol·L-1(填精确值)。
查看习题详情和答案>>
工业制硝酸的主要反应为:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g)? △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的△H=???????????????????????? 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:

①反应在第2 min到第4 min时,O2的平均反应速率为?????????????????? 。
②反应在第6 min时改变了条件,改变的条件可能是????????? (填序号)。
A.使用催化剂????? B.升高温度? C.减小压强????? D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是??????? (填序号)。
A.单位时间内生成n mol NO的向时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为____????? 。
②该电池正极的电极反应式为:???????????????????????? 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是?????????????????????????????????? (用相关的离子方程式表示)。

查看习题详情和答案>>
(12分)某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ.用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号) ,该错误操作会导致测定结果 (填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应 :判断滴定终点的现象是 。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果 (填“偏大”、“偏小”或“无影响’')。
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
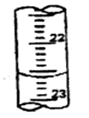
②烧碱样品的纯度为 % 。 查看习题详情和答案>>
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。 2CO2(g)+6H2(g)
 CH3CH2OH(g) +3H2O(g) △H=akJ.mol-1 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g) +3H2O(g) △H=akJ.mol-1 在一定压强下,测得上述反应的实验数据如下表。 
①上述反应的a____________0(填“大于”或“小于”)。
②在一定温度下,提高氢碳比,则CO2转化率___________(填“增大”“减小” 或“不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示

②在一定温度下,2 mol CO(g)和4 mol H2 (g)反应达到平衡时,生成b mol CH3CH2OH(g)和b mol H2O(g),若向上述密闭容器中加入4 mol CO、8 mol H2 及固体催化剂,使之反应。平衡时,反应产生的热量Q__________2E2(填“>”“<” 或“=”);生成CH3CH2OH的物质的量___________2b(填“>”“<”或“=”),你的判 断依据是________________。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理 与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是________________。
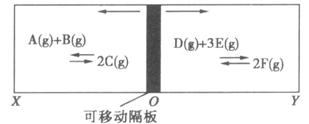
(1)现若将环境温度升高,则:
①反应A+B![]() 2C的正反应速率(v1)与逆反应速率(v2)之间的关系为:v1________v2(填“>”“<”或“=”)
2C的正反应速率(v1)与逆反应速率(v2)之间的关系为:v1________v2(填“>”“<”或“=”)
②隔板向________(填“左”或“右”)移动。
(2)若XO/OY=y:
①y=1.2时,D的转化率为_____________________________
②y的取值范围是多少?答:____________________________
查看习题详情和答案>>