题目内容
(12分)某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ.用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号) ,该错误操作会导致测定结果 (填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应 :判断滴定终点的现象是 。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果 (填“偏大”、“偏小”或“无影响’')。
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
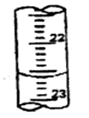
| 第三次 | 20.00 | 2.38 | a |
②烧碱样品的纯度为 % 。
(12分)(1) 500ml容量瓶(1分) (2)①Ⅰ(2分) 偏大(1分)
②注视锥形瓶中溶液颜色的变化(1分)
溶液由红色刚好变为无色,且半分钟内不变色(2分)
③偏小(1分) (3) ①22.60(2分) ②80.8%(2分)
解析试题分析:(1) 配制500ml溶液时,需要500ml容量瓶,所以还需要500ml容量瓶。
(2)①滴定管用水洗涤后,还需要用标准液润洗,否则相当于稀释溶液,因此盐酸的浓度降低,消耗的盐酸溶液体积偏大,则测定结果偏高。
②步骤Ⅳ中滴定时眼睛应注视锥形瓶中溶液颜色的变化。由于选择的指示剂是酚酞,所以终点时的现象是溶液由红色刚好变为无色,且半分钟内不变色。
③若步骤II中仰视读数,则读数偏大。步骤Ⅳ中俯视读数,读数偏小,所以消耗溶液的体积偏少,因此测定结果偏小。
(3)根据滴定管的结构可知,此时的读数应该是a=22.60ml。根据表中数据可知,三次实验中消耗盐酸的体积是20.18ml、20.20ml、20.22ml,所以三次实验的平均值是20.20ml,则氢氧化钠的物质的量是0.00202mol,则纯度是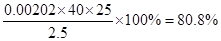 。
。
考点:考查酸碱中和滴定的有关判断、计算以及有关误差分析等
点评:判断中和滴定中的误差分析的总依据为:由C测==C标V标/V测。由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小。根据产生误差的来源,从以下几个方面来分析:①洗涤误差;②读数误差;③气泡误差;④锥形瓶误差;⑤变色误差;⑥样品中含杂质引起的误差等,需要具体问题具体分析。

 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步: