网址:http://m.1010jiajiao.com/timu3_id_333742[举报]
在实验室用MnO2与浓盐酸混合加热制取Cl2,可以代替MnO2的物质为
- A.酸性比MnO2更强的P2O5或SO3
- B.碱性比MnO2更强的Na2O和MgO
- C.还原性比MnO2更强的H2S或HI
- D.氧化性比MnO2更强的KMnO4或K2Cr2O7

(1)A是氯气发生装置,除了酒精的外还用到的玻璃仪器有
(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式
(3)同学们在实验中发现:若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成.“影响氯气生成的原因是什么呢?”同学们作了如下探究:
①提出合理假设
假设1:Cl-的浓度对反应的影响;假设2:
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸
| 实验序号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
| ||
(1)若制得标准状况下11.2L Cl2,则被氧化的HCl为
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
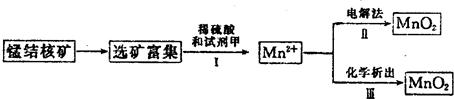
①步骤Ⅰ中,试剂甲必须具有的性质是
a.氧化性 b.还原性 c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1的NaClO3溶液200mL,该反应的离子方程式为
(4)用100mL12.0mol?L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30mol,请你分析可能的原因为
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)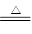 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
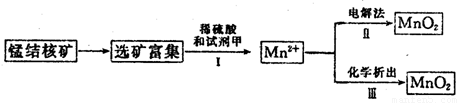
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
查看习题详情和答案>>
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)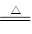 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。